
- •Продуценты в биотехнологии Бактерии
- •Дрожжи (внетаксономическая группа грибов, утративших мицелиальное строение)
- •3.1. Смешанные культуры микроорганизмов. Использование. Типы взаимодействия между микроорганизмами в смешанной культуре.
- •3.2. Отличия биотехнологических процессов от химических. Обобщенные схемы основных производств микробиологического синтеза.
- •3.3. Биотехнология получения витаминов на примере витамина b12.
- •3.4. Общие показатели загрязненности сточных вод. Классификация методов очистки сточных вод.
- •4. Бактериальные и биологические загрязнения сточных вод
- •3.5. Среднее время пребывания потока в аппарате, как одна из основных характеристик кривых распределения. С- и f- кривые. Моменты с-кривой и их сущность.
- •4.1. Конкурентное ингибирование в периодической и хемостатной культуре.
- •4.2. Сорбционные методы выделения продуктов биосинтеза.
- •4.3. Уксусная кислота. Методы получения. Технология уксуснокислого брожения.
- •4.4. Ксенобиотики как загрязняющие факторы окружающей среды
- •1. Ксенобиотический профиль биогеоценоза
- •2. Пути переноса и трансформации ксенобиотиков
- •4. Ксенибиотики (кб) как зазрязняющие факторы ос. Основные источники поступления. Пути миграции и превращения.
- •5.1.Пищевая конкуренция в смешанных культурах. Влияние условий культивирования на состав популяций. Аутостабилизация фактора, ограничивающего развитие популяции.
- •5.2. Конструкции барботажных и барботажно-эрлифтных ферментеров.
- •5.2. Ферментеры газлифтные колонные и тарельчатые. Достоинства и недостатки.
- •5.3. Аминокислоты. Биосинтез, производство и характеристика лизина.
- •5.4 Аэробная очистка сточных вод. Последовательные стадии очистки.
- •5.6. Решение:
- •6.2. Сублимационная сушка.
- •6.3. Направленный синтез аминокислот и его регуляция. Ферментативная конверсия субстратов в аминокислоты.
- •6.4. Особенности микробиологической трансформации отдельных классов органических ксенобиотиков (пестициды, пав, органические галогенированные соединения).
- •7.1. Основные фазы роста и развития микробной культуры при периодическом культивировании.
- •7.3. Пищевая биотехнология. Производство молочных продуктов.
- •7.4. Микробиологические превращения металлов. Биосорбция металлов из растворов.
- •7.5. Аппаратурное оформление и основные принципы процесса ректификации.
- •8.1. Параметры роста культур микроорганизмов: скорость роста, время генерации, скорость деления, время удвоения. Эффективность биосинтеза.
- •8.2. Методы очистки и стерилизации воздуха. Аппаратурное оформление операций.
- •8.3.Продуценты белка
- •8.4. Характеристика анаэробных реакторов. Методика расчета менатенка. Области применения анаэробной очистки сточных вод. Сравнительный анализ эффективности работы аэробных и анаэробных реакторов.
- •8.5. Этапы процесса проектирования. Этапы создания детализированной технологической схемы, предварительной компоновки оборудования и корректировки начальной технологической схемы.
- •9.1. Особенности, условия и приемы культивирования изолированных тканей.
- •9.2. Экстракция. Применение в биотехнологии. Способы экстрагирования.
- •9.3. Спиртовое брожение. Производство этилового спирта. Области применения. Сырье, технологическая схема.
- •10.1. Одноступенчатое гомогенное культивирование микроорганизмов с рециркуляцией. Преимущества и недостатки.
- •10.2. Охрана труда, техника безопасности и санитарный контроль микробиологических производств.
- •10.3. Глутаминовая кислота: способы получения, биосинтез и схема получения.
- •10.4.Химия и использование бактериального окисления сульфидных минералов. Выщелачивание куч и отвалов, подземное выщелачивание
- •Механизм бактериального выщелачивания
- •Организация выщелачивания
- •10.5. Конструкции теплообменных аппаратов.
- •11.1 Влияние условий культивирования на скорость роста микроорганизмов.
- •11.2. Способы выделения биолологически активных веществ из биомассы микроорганизмов.
- •11.3. Лимонная кислота. Биосинтез. Технологическая схема производства.
- •11.4. Бактериальное выщелачивание.
- •11.5. Выпаривание. Температура кипения растворов (ткр). Температурная депрессия (тд). Технические методы выпаривания (тмв).
6.2. Сублимационная сушка.
Метод основан на удалении влаги из замороженного состояния. Причем влага в виде льда переходит в газообразную фазу, минуя жидкую. Материал находится при температуре -20÷-30ºC и лишь в конце сушки температура повышается до 30 - 40ºC. Давление 0,1 – 10 Па.
Существуют три стадии сублимационной сушки: замораживание, сублимация и сушка.
Установка состоит из сублиматора с плитами, на которых размещается высушиваемый продукт. Циркулирующий внутри плит теплоноситель охлаждает плиты при замораживании продукта или нагревает при сушке. Конденсация паров влаги происходит в конденсаторе, куда подается хладоноситель от холодильной установки. Неконденсирующиеся пары из конденсатора – вымораживателя удаляются вакуум-насосом. При снижении давления в сушильной камере происходит быстрое самозамораживание влаги и сублимация льда за счет тепла, отдаваемого самим материалом. При сублимации удаляется основная часть влаги, это период постоянной скорости сушки. Удаление остаточной влаги – тепловой сушкой.

Область применения – сушка термолабильных продуктов: препараты крови, антибиотики, гормоны, витамины, ферменты.
6.3. Направленный синтез аминокислот и его регуляция. Ферментативная конверсия субстратов в аминокислоты.
Возможность получения биологически активных L-аминокислот на основе возобновляемого сырья составляет главное- преимущество микробиологического способа получения аминокислот по сравнению с методами их химического синтеза.Способность штаммов микроорганизмов продуцировать аминокислоты связана с генетическими нарушениями тех систем регуляции клеточного метаболизма,которые предотвращают избыточное образование и выделение клеткой аминокислот.Репрессия и ретроингибирование ферментов, катализирующих специфический путь биосинтеза данной аминокислоты,а также барьер
проницаемости, создаваемый клеточной мембраной,составляют основной механизм негативного контроля, обеспечивающего экономный синтез ферментов и промежуточных метаболитов и сохраняющего в клетке уровень аминокислот,необходимый для последующего синтеза макромолекул. Распространенными объектами селекции продуцентов аминокислот являются микроорганизмы рода Corynebacterium.Эти бактерии имеют очень простые пути регуляции,мало подвержены фаголизису,имеют ряд других ценных свойств.
Аминокислоты синтезируются коринебактериями из промежуточных продуктов гликолиза, пентозофосфатного цикла, цикла трикарбоновых кислот,т.е.несколькими биосинтетическими путями и образуют целый ряд семейств.Так,биосинтез
ароматических аминокислот начинается с конденсации фосфоенолпирувата
и эритрозо-4-фосфата. Аминокислоты с углеодородными заместителями — аланин, лейцин, валин — образуются из пировиноградной кислоты (семейство этой кислоты); серии, глицин, цистеин (семейство серина)— из 3-фосфоглицериновой или глиоксиловой кислот. Глутаминовая кислота, пролин и аргинин образуются на базе а-кетоглутаровой кислоты (се-
мейство этой кислоты),участвующей в ЦТК. Щавелевоуксусная кислота, также входящая в ЦТК, является предшественником аминокислот семейства аспарагиновой кислоты (лизин,метионин,треонин,изолейцин).В ходе биосинтеза аминокислот азот вводят в аммонийной форме или в форме аминогруппы через реакции ферментативного восстановительного аминирования.

Сверхпродуцирование таких микробных первичных метаболитов,как аминокислоты,может быть вызвано следующими обстоятельствами:
1)увеличением степени утилизации субстрата;
2)повышением скорости образования и активности ферментов биосинтеза аминокислот;
3)ингибированием активности или подавлением синтеза ферментов,связанных с утилизацией культурой продуцированных целевых аминокислот;
4)стимуляцией выделения продукта во внеклеточную среду;
5 )стимуляцией
образования углеродного и азотного
предшественников целевых аминокислот.
)стимуляцией
образования углеродного и азотного
предшественников целевых аминокислот.
Многие аминокислоты получают с помощью ферментов: гидролаз,аммиаклиаз,пиридоксаль-5'-фосфатзависимых ферментов и др.Отдельные аминокислоты синтезируют,используя ин-
дивидуальные ферменты (например,получение L-аспарагиновой кислоты из фумаровой с помощью аспартазы),для получения других применяют комбинации ферментов (например, получение L-цистеина из 2-амино-Δ2-тиазолин-4-карбоновой кислоты с экстрактом Pseudomonas thiazolinophilum).
И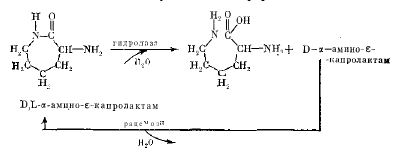 сточником
фермента для осуществления технологического
процесса могут служить биомасса клеток,
взятых сразу после культивирования
(обычно в конце экспоненциальной фазы
роста);лизированные ацетоном клетки;
клетки после сублимационной сушки;
сточником
фермента для осуществления технологического
процесса могут служить биомасса клеток,
взятых сразу после культивирования
(обычно в конце экспоненциальной фазы
роста);лизированные ацетоном клетки;
клетки после сублимационной сушки;
к леточный
экстракт; очищенный ферментный препарат
и,наконец,нерастущие иммобилизованные
клетки. Иммобилизация клеток является
новой биотехнологией, которая включает
их фиксацию на мембранном (пористом для
низкомолекулярных веществ)носителе
(хлопковая вата,силикагель,бентонит,полиакриламидный
гель,полисахарид,каррагинан и др.).Такие
клетки имеют большой период полуинактивации
(иногда более 100 сут)и представляют собой
биокатализатор многократного действия.
леточный
экстракт; очищенный ферментный препарат
и,наконец,нерастущие иммобилизованные
клетки. Иммобилизация клеток является
новой биотехнологией, которая включает
их фиксацию на мембранном (пористом для
низкомолекулярных веществ)носителе
(хлопковая вата,силикагель,бентонит,полиакриламидный
гель,полисахарид,каррагинан и др.).Такие
клетки имеют большой период полуинактивации
(иногда более 100 сут)и представляют собой
биокатализатор многократного действия.
П о л у ч е ние L -л и з и на. Наиболее распространенным с технологической точки зрения является метод получения L-лизина из D,L-α-амино-ε-капролактама.Для осуществления процесса первоначально комбинацией химических реакций из циклогексена получают D,L-α-амино-ε-капролактам
П оследний
используют в качестве субстрата
ферментативного декарбоксилирования.
Процесс включает селективный гидролиз
D,L-α-амино-ε-капролактама
в L-лизин и превращение остаточного
α-амино-ε -капролактама D-формы в смесь
энантиомеров.
оследний
используют в качестве субстрата
ферментативного декарбоксилирования.
Процесс включает селективный гидролиз
D,L-α-амино-ε-капролактама
в L-лизин и превращение остаточного
α-амино-ε -капролактама D-формы в смесь
энантиомеров.
α-Амино-ε-капролажтам-гидролаза (лактамаза)обнаружена в клетках Candida laurentii и других дрожжах, и ее синтез может быть индуцирован добавлением D,L-α-амино-ε-капролактама (или L-a-амино-е-капролактама),а активность —ионами Mg 2+ и Мп 2+ .
а-Амино-е-капролактам-рацемаза найдена в Alcaligenes obae и других бактериях.При получении L-лизина воздействуют двумя ферментами на субстрат. В водный раствор D,L-a-амино-е-капролактама вводят необходимое количество дрожжевых и бактериальных клеток,обладающих гидролазной и рацемазной активностью. При рН 8,0 —8,5 и температуре 30 — 50 °С D,L-α-амино-ε-капролактам количественно переходит в L-лизин.Отметим,что оба фермента (точнее,оба вида клеток)можно получить в иммобилизованном виде.
П о л у ч е ние L -а с п а р а г и н о вой к и с л о ты. В настоящее время разработан и успешно реализован в промышленном масштабе метод получения аспарагиновои кислоты на основе рекомбинантных и иммобилизованных клеток продуцентов —аспартатаммиаклиазы (аспартазы).Клетки Е.coli,содержащие аспартазу,катализировали присоединение аммиака к фумаровой кислоте с образованием L-аспарагиновой кислоты .Аспартаза — внутриклеточная лиаза — синтезируется не только клетками Е.coli,но и некоторыми другими микроорганизмами и растениями.Глюкоза репрессирует синтез фермента,и эта репрессия снимается циклическим АМФ.Органические соединения азота,включая аминокислоты,усиливают образование фермента.Анаэробное культивирование предпочти-
тельно для синтеза фермента.Активность иммобилизованных в .полиакриламидный гель клеток сохранялась при повышенной температуре (37 °С)в присутствии ионов Mg
в течение 40 сут при рН 8,5,причем выход аспарагиновои кислоты составлял 95 — 100%(при концентрации фумаровой кислоты 1 — 1,8 моль/л).Плотность иммобилизованных клеток на носителе составляла 500 г сырой биомассы на 1 л объема. Технология получения L-
аспарагиновой кислоты — один из первых примеров использования в промышленности иммобилизованных живых клеток микроорганизмов, содержащих аспартазу.
В табл. приведены аминокислоты (целевые продукты),субстрат, ферментативная реакция, источник фермента и продуктивность каждой реакции.
