
153 :: 154 :: 155 :: 156 :: 157 :: 158 :: 159 :: Содержание
Класс Споровики (Sporozoa)
Плазмодий живой (Plasmodium vivax)
К классу споровиков относят малярийный плазмодий (Plasmodium vivax) - возбудитель малярии.
Малярия чаще встречается в странах с жарким и влажным климатом, расположенных в тропическом и субтропическом поясе. Заболевание малярией выражается в приступах озноба, сопровождающихся подъемами температуры, повторяющимися с определенной частотой.
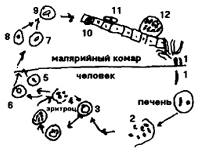
Заражение человека происходит при укусе самками малярийного комара, содержащими в слюне малярийный плазмодий на стадии спорозоита (рис. 93). Спорозоиты имеют размеры 5 - 8 мкм. Током
153
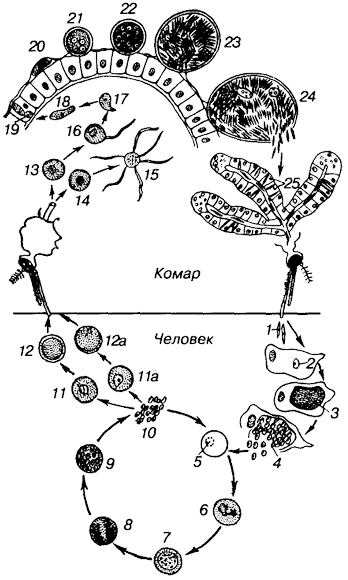
Рис. 93. Цикл развития малярийного плазмодия рода Plasmodium (по Е. М. Хейсину). 1 - спорозоиты; 2-4 - шизогония в печени (2 - спорозоит, внедрившийся в печеночную клетку; 3 - растущий шизонт с многочисленными ядрами; 4 - шизонт, распадающийся на мерозоиты); 5-10 - эритроцитарная шизогония (5 - молодой шизонт в форме кольца; 6 - растущий шизонт с псевдоподиями; 7-8 - деление ядер внутри развивающегося шизонта; 9-10 - распад шизонта на мерозоиты и выход их из эритроцита, кроме мерозоитов, видны зерна пигмента); 11 - молодой макрогамонт; 11а - молодой микрогамонт; 12 - зрелый макрогамонт; 12а - зрелый микрогамонт; 13 - макрогамета; 14 - микрогамонт; 15 - образование микрогамет (флагелляция); 16 - копуляция; 17 - зигота; 18 - подвижная зигота (оокинета); 19 - проникновение оокинеты сквозь стенку желудка комара; 20 - превращение оокинеты в ооцисту на наружной стенке желудка комара; 21,22 - растущая ооциста с делящимися ядрами; 23 - зрелая ооциста со спорозоитами; 24 - спорозоиты, покидающие ооцисту; 25 - спорозоиты в слюнной железе комара.
154
крови они разносятся по телу и внедряются в клетки печени, где превращаются в шизонтов, размножающихся бесполым путем (шизогонией). В результате этого образуются мерозоиты, которые внедряются в эритроциты, где снова растут и делятсяшизогонией. Цикл развития мерозоитов в эритроцитах повторяется несколько раз.
Правильное чередование приступов при малярии связано с периодичностью шизогонии в эритроцитах. Начало приступа (озноб) совпадает с распадом эритроцитов, поступлением в плазму крови мерозоитов и продуктов их жизнедеятельности, вызывающих интоксикацию организма.
После нескольких циклов бесполого размножения (шизогонии) начинается подготовка к половому процессу. При этом мерозоиты, находящиеся в эритроцитах, дают начало гамонтам (подготовительная стадия образования гамет). Макрогамонты дают впоследствии женские половые клетки (макрогаметы), микрогамонты - мужские (микрогаметы). В крови у человека не происходит образования половых клеток, так как человек - промежуточный хозяин в цикле развития малярийного плазмодия.
Дальнейшее развитие плазмодия осуществляется только тогда, когда гамонты с кровью попадают в желудок малярийного комара при сосании. Малярийные комары - окончательные хозяева в цикле развития малярийного плазмодия. В желудке комара гамонты превращаются в неподвижные макрогаметы и мелкие подвижные микрогаметы. Происходит копуляция макро- и микрогамет, в результате чего образуется подвижная зигота (оокинета), которая внедряется в стенку желудка комара. На стороне, обращенной в полость тела, оокинета инцистируется и становится ооцистой.
Ядро зиготы многократно делится. Ооциста распадается на большое количество (до 10 000) спорозоитов. Оболочка ооцисты разрушается, и спорозоиты попадают сначала в полость тела комара, затем в его слюнные железы. Малярийный комар вновь может заражать человека. Инкубационный период длится от 2 нед до 6 мес. Диагноз ставят по нахождению малярийных плазмодиев в крови. Кровь берут непосредственно после приступа малярии. Профилактика связана с уничтожением мест обитания малярийных комаров.
155
Табл. 3 Тип ПРОСТЕЙШИЕ (PROTOZOA). Паразитические
КЛАССЫ |
SARCODINA (Саркодовые) |
FLAGELLATA (Жгутиконосцы) |
CILIATA (Ресничные) |
SPOROZOA (Споровики) |
ПРЕДСТАВИТЕЛИ |
ENTAMOEBA HISTOLITICA Дизентерийная амеба |
LEISHMANIA TROPICA Лейшмания |
BALANTIDIUM COLI Балантидий |
PLASMODIUM VIVAX Плазмодий малярийный |
СТРОЕНИЕ |
1 - Ядро 2 - Эритроциты 3 - Цитоплазма |
1 - Жгутик 2 - Ядро 3 - Цитоплазма |
1 - Клеточный рот 2 - Клеточная глотка 3 - Сократительная вакуоль 4 - Пищеварительная вакуоль 5 - Макронуклеус 6 - Микронуклеус 7 - Порошица 8 - Реснички 9 - Цитоплазма |
1 - Ядро 2 - Цитоплазма 3 - Эритроцит 4 - Пищеварительная вакуоль |
ФОРМА ТЕЛА |
Непостоянная |
Постоянная |
Постоянная |
Постоянная |
КОЛ-ВО ЯДЕР |
Одно (1) |
Одно (2) |
Два (5, 6) |
Одно (1) |
ОРГАНЕЛЛЫ ПЕРЕДВИЖЕНИЯ |
Ложноножки, псевдоподии |
Жгутик |
Реснички |
|
ПИТАНИЕ |
Гетеротрофное (Эритроциты - 2) |
Гетеротрофное |
Гетеротрофное: 1) Клеточный рот (1) 2) Клеточная глотка (2) 3) Пищеварительная вакуоль (4) 4) Порошица |
Гетеротрофное. Осмотически |
156
Продолжение табл. 3
ФОРМЫ СУЩЕСТВОВАНИЯ |
Вегетативная; циста |
Вегетативная |
Вегетативная; циста |
Вегетативная; циста |
ЦИКЛ РАЗВИТИЯ |
1. Циста, попавшая в пищеварительный тракт 2. Выход амебы из цисты 3,4. Мелкая вегетативная форма 5. Крупная вегетативная форма 6. Циста в кишечнике |
|
1 - Вегетативная 2 - Циста |
1 - Спорозоит 2 - Шизогония в печени 3 - Мерозоит в эритроц. 4 - Шизогония в эритроц. 5 - Микрогамонты 6 - Макрогамонты 7 - Микрогаметы 8 - Макрогаметы 9 - Зигота 10 - Оокинета 11 - Ооциста 12 - Ооциста со спорозоитами |
РАЗМНОЖЕНИЕ |
Бесполое |
Бесполое |
Бесполое, половое |
Бесполое, половое |
ПЕРЕНОСЧИКИ ВОЗБУДИТЕЛЕЙ |
Мухи домашние |
Москиты |
Мухи домашние |
Малярийный комар |
НАЗВАНИЕ БОЛЕЗНИ |
Амебиаз |
Кожный лейшманиоз |
Балантидиаз |
Малярия |
СПОСОБ ЗАРАЖЕНИЯ ЧЕЛОВЕКА |
Вода, грязные овощи, фрукты |
Укус москита |
Вода, грязные руки, овощи, фрукты |
Укус малярийного комара |
ГДЕ ПАРАЗИТИРУЕТ У ЧЕЛОВЕКА |
В толстом кишечнике |
На коже |
В толстом кишечнике |
В печени, крови |
Маляри́йные комары́, ано́фелесы (лат. anopheles, от др.-греч. ’ανωφελής — видный[1]) — подсемейство Anophelinae, включающее единственный род Anopheles, многие виды которого являются переносчиками паразитов человека — малярийных плазмодиев (около 10 видов, из которых наиболее распространены Plasmodium malariae, Plasmodium falciparum, Plasmodium ovale и Plasmodium vivax).
Содержание [убрать] 1 Распространение 2 Развитие личинок 3 Малярийный плазмодий 4 Интересные факты 5 Генетика 6 Примечания 7 Литература 8 Ссылки |
[править]Распространение
Распространены широко на всех континентах, кроме Антарктиды. Отсутствуют в пустынных областях и на крайнем севере (крайняя северная точка ареала — юг Карелии). В мировой фауне около 400 видов, в России и сопредельных странах — 10 видов. В России обитают в Европейской части и Западной Сибири. Не живут в Восточной Сибири, где зимы являются слишком суровыми для них.[источник не указан 159 дней]
[править]Развитие личинок
Жизненный цикл комара связан с водоёмами, в которых происходит откладка яиц и развитие личинок. Личинки относятся к гипонейстону. Они прикрепляются спинной стороной тела к нижней стороне поверхностной пленки с помощью особых пальмовидных волосков. При питании личинка поворачивает голову на 180 градусов и фильтрует мелкие частицы с помощью фильтрующих вееров. Оптимальная температура, нижний и верхний температурный предел развития личинок зависит от видового состава комаров. Так An. maculipennisтеплолюбивые и населяют хорошо освещенные и прогреваемые солнцем водоемы, нормальная жизнедеятельность личинок протекает при температурах между 10 и 35 °C. Оптимальная температура в пределах 25 — 30 °C. An. hyrcanus развитие личинок протекает в пределах 12 — 35 °C, оптимум 25 — 30 °C. An. claviger выплод приурочен обычно к затененным водоемам. Температурные пределы развития 7 — 21 °C, оптимальная 14 — 16 °C. Для An. pulcherrimus благоприятные водоемы со средними температурами 31 — 32 °C и максимальными 35 — 40 °C. Для An. superpictus оптимальная температура воды для развития личинок — 30 °C, а максимальная 35 — 38 °C.[источник не указан 159 дней]
[править]Малярийный плазмодий
Комар заражается малярийным плазмодием от человека — больного или носителя. Малярийный плазмодий проходит в организме комара цикл полового размножения. Заражённый комар становится источником инфекции для человека через 4-10 дней после заражения и является таковым в течение 16-45 дней. Служат комары переносчиками и других видов плазмодиев, которые вызывают малярию у животных.[источник не указан 159 дней]
[править]Интересные факты
В обиходе «малярийными комарами» часто называют больших комаров-долгоножек (семейство Tipulidae), но это совершенно неправильно. Долгоножки питаются соками растений и абсолютно безвредны для человека.
Вопрос № 16-18
Малярия
Информационный бюллетень N°94 Декабрь 2011 г.

Основные факты
Малярия – это представляющая угрозу для жизни болезнь, вызываемая паразитами, которые передаются людям при укусах инфицированных комаров.
По оценкам, в 2010 году малярия привела почти к 655 000 случаев смерти, преимущественно среди африканских детей.
Малярия предотвратима и излечима.
Усиленные меры по профилактике малярии и борьбе с ней способствуют значительному уменьшению бремени этой болезни во многих районах.
В странах с высокими показателями болезни малярия может способствовать уменьшению валового внутреннего продукта на целых 1,3%.
Не имеющие иммунитета люди, совершающие поездки из районов, где нет малярии, крайне уязвимы перед болезнью в случае инфицирования.
По оценкам "Всемирного доклада о малярии 2011 г.", в 2010 году произошло 216 миллионов случаев заболевания малярией и предположительно 655 000 случаев смерти. Показатели смертности от малярии на глобальном уровне снизились на 25% с 2000 года и на 33% в Африканском регионе. Большинство случаев смерти происходит среди детей в Африке, где каждуюминуту от малярии умирает ребенок, и на эту болезнь приходится примерно 22% всех случаев смерти детей.
Малярию вызывают паразиты Plasmodium. Эти паразиты передаются людям при укусах инфицированных комаров Anopheles, называемых "переносчиками малярии", которые кусают, главным образом, в темное время суток. Существует четыре типа паразитов, которые вызывают малярию у человека:
Plasmodium falciparum
Plasmodium vivax
Plasmodium malariae
Plasmodium ovale
Наиболее широко распространены Plasmodium falciparum и Plasmodium vivax, а самым смертоносным типом является Plasmodium falciparum.
За последние годы произошло также несколько случаев заболевания людей малярией Plasmodium knowlesi – малярией обезьян, которая встречается в некоторых лесных районах Юго-Восточной Азии.
Передача инфекции
Малярия передается исключительно через укусы комаров Anopheles. Интенсивность передачи зависит от факторов, связанных с паразитом, переносчиком, инфицированным человеком и окружающей средой.
В мире существует около 20 различных видов комаров Anopheles, имеющих местную значимость. Все из значимых видов переносчиков инфекции кусают ночью. Комары Anopheles размножаются в воде, и каждый вид предпочитает определенные типы водоемов для размножения. Так, например, некоторые виды предпочитают мелководные пресные водоемы, такие как лужи, рисовые поля и следы от копыт. Более интенсивная передача инфекции происходит в местах с более длительной продолжительностью жизни комаров (при которой паразит имеет достаточно времени для завершения своего развития в организме комара) и там, где переносчик предпочитает кусать людей, а не животных. Так, например, длительная продолжительность жизни африканских видов переносчиков и их явное предпочтение кусать людей, являются основными причинами того, что более 85% всех случаев смерти от малярии происходит в Африке.
Передача инфекции зависит также от климатических условий, которые могут влиять на численность и выживаемость комаров – это режим распределения осадков, температура и влажность. Во многих местах передача инфекции носит сезонный характер и достигает пика во время сезонов дождей и сразу же после них. Эпидемии малярии могут происходить в случаях, когда климатические и другие условия внезапно становятся благоприятными для передачи инфекции в районах, где люди имеют слабый иммунитет к малярии или не имеют его вообще. Кроме того, эпидемии могут происходить в тех случаях, когда люди со слабым иммунитетом попадают в районы с интенсивной передачей малярии, например, в поисках работы или в качестве беженцев.
Другим важным фактором является иммунитет человека, особенно среди взрослых людей в районах с умеренной или интенсивной передачей инфекции. Иммунитет вырабатывается под воздействием инфекции на протяжении целого ряда лет, и, несмотря на то, что он никогда не обеспечивает полной защиты, риск развития тяжелой болезни в случае малярийной инфекции снижается. По этой причине большинство случаев смерти от малярии в Африке происходит среди детей раннего возраста, тогда как в районах с более низким уровнем передачи и низким иммунитетом риску подвергаются все возрастные группы.
Симптомы
Малярия – это острая лихорадочная болезнь. Симптомы появляются через семь или более дней (обычно через 10-15 дней) после укуса инфицированного комара. Первые симптомы – лихорадка, головная боль, озноб и рвота – могут быть несильно выраженными, что затрудняет выявление малярии. Если не начать лечение в течение первых 24 часов, малярия P. falciparum может развиться в тяжелую болезнь, часто заканчивающуюся смертельным исходом. У детей с тяжелой малярией часто развивается один или более следующих симптомов: тяжелая анемия, дыхательная недостаточность в связи с метаболическим ацидозом или церебральная малярия. У взрослых людей также часто наблюдается поражение нескольких органов. В эндемичных по малярии районах у людей может развиваться частичный иммунитет, при котором инфекции протекают без симптомов.
В случаях P. vivax и P. ovale через несколько недель или месяцев после инфицирования могут происходить клинические рецидивы, даже если пациент покинул эндемичный по малярии район. Эти рецидивы происходят из-за "дремлющих" в печени форм паразитов (отсутствующих в случаях P. Falciparum и P.malariae), и для полного излечения необходима специальная терапия, нацеленная на эти стадии развития в печени.
Кто подвергается риску?
Риску заболевания малярией подвергается примерно половина населения мира. Большинство случаев заболевания малярией и смерти от нее происходит в Африке к югу от Сахары. Однако Азия, Латинская Америка и, в меньшей степени, Ближний Восток и отдельные части Европы также охвачены этой болезнью. В 2010 году малярия была зарегистрирована в 106 странах и территориях. Группы населения особого риска включают следующие:
Дети раннего возраста: в районах устойчивой передачи инфекции, дети, у которых еще не развился защитный иммунитет против самых тяжелых форм этой болезни.
Не имеющие иммунитета беременные женщины: малярия приводит к большому числу выкидышей (до 60% в случаях инфекции P. falciparum), а показатели материнской смертности составляют 10-50%.
Частично иммунизированные беременные женщины: в районах с высоким уровнем передачи инфекции малярия может приводить к выкидышам и рождению детей с низкой массой тела, особенно в случаях первой и второй беременностей. По оценкам, в результате малярийной инфекции матерей во время беременности ежегодно умирает 200 000 детей грудного возраста.
ВИЧ-инфицированные беременные женщины с частичным иммунитетом: в районах с устойчивой передачей инфекции эти женщины подвергаются повышенному риску заболевания малярией во время всех беременностей. К тому же, в случаях малярийной инфекции плаценты существует повышенный риск передачи ВИЧ-инфекции от матерей новорожденным.
Люди с ВИЧ/СПИДом
Лица из неэндемичных районов, совершающие международные поездки в связи с отсутствием у них иммунитета.
Иммигранты из эндемичных районов и их дети: живущие в неэндемичных районах и возвращающиеся в свои родные страны с тем, чтобы навестить друзей и родственников, эти люди также подвергаются риску в связи с ослабевающим или отсутствующим иммунитетом.
Диагностика и лечение
Ранняя диагностика и лечение малярии способствуют ослаблению тяжести болезни и предотвращению смерти. Это также способствует снижению уровня передачи малярии.
Наилучшим имеющимся лечением, особенно в случае малярии P. falciparum, является основанная на артемизинине комбинированная терапия (АКТ).
Согласно рекомендациям ВОЗ, до предоставления лечения все предполагаемые случаи малярии необходимо подтверждать диагностическим тестированием (либо микроскопией, либо диагностическим экспресс-тестом), нацеленным на выявление паразита. Результаты паразитологического подтверждения могут быть получены за несколько минут. Лечение на основании одних лишь симптомов необходимо предоставлять только в тех случаях, когда паразитологический диагноз невозможен. Более детальные рекомендации доступны в "Руководящих принципах по лечению малярии".
Лекарственная устойчивость
Растущая устойчивость к противомалярийным препаратам распространяется быстрыми темпами, что подрывает усилия по борьбе с малярией.
При лечении монопрепаратами на основе артемизинина пациенты могут преждевременно прекращать лечение в связи с быстрым исчезновением симптомов малярии. При таком незавершенном лечении в крови у пациентов остаются устойчивые паразиты. Без второго препарата, предоставляемого в качестве компонента комбинированной терапии (как это делается при АКТ), эти устойчивые паразиты выживают и могут быть переданы комару, а затем другому человеку. Поэтому, монотерапия является одной из основных причин распространения устойчивости к артемизинину.
Если устойчивость к артемизинину получит дальнейшее развитие и распространится в другие крупные географические районы, как это случилось ранее с хлорохином и сульфадоксином-пириметамином (СП), последствия для здоровья людей могут быть катастрофическими, так как альтернативных противомалярийных лекарств, по крайней мере, в ближайшие пять лет не появится.
ВОЗ рекомендует проводить регулярный мониторинг устойчивости к противомалярийным препаратам и поддерживает страны в активизации их усилий в этой важной области работы.
Более детальные рекомендации доступны в "Глобальном плане сдерживания устойчивости к артемизинину" (GPARC).
Профилактика
Борьба с переносчиками является основным способом снижения уровня передачи малярии в отдельных сообществах. Это единственное мероприятие, которое может снизить передачу малярии с очень высоких уровней практически до нуля.
В области личной профилактики малярии первой линией обороны является индивидуальная защита от укусов комаров.
В разнообразных условиях эффективны два вида борьбы с переносчиками:
Обработанные инсектицидом противомоскитные сетки (ОИС): предпочтительным типом ОИС для медико-санитарных программ по распространению являются сетки, пропитанные инсектицидом длительного действия (СИДД). ВОЗ рекомендует обеспечивать охват всех людей, подвергающихся риску, а в большинстве мест самым эффективным по стоимости способом достижения этой цели является предоставление СИДД с тем, чтобы каждый человек в районах с высокими уровнями передачи малярии каждую ночь спал под СИДД;
Распыление внутри помещений инсектицидов остаточного действия: распыление инсектицидов остаточного действия внутри помещений (РИОДВП) является самым действенным способом быстрого снижения уровня передачи малярии. Полный потенциал этого мероприятия реализуется при условии, что распыление производится, по меньшей мере, в 80% домов в целевых районах. Распыление внутри помещений эффективно в течение 3-6 месяцев, в зависимости от используемого инсектицида и типа поверхностей, на которые производится распыление. ДДТ может быть эффективным в некоторых случаях в течение 9-12 месяцев. Разрабатываются инсектициды для РИОДВП более длительного действия.
Для профилактики малярии могут также использоваться лекарственные препараты. Профилактику малярии среди людей, совершающих поездки, можно осуществлять с помощью химиотерапии, которая подавляет стадию малярийной инфекции в крови, предотвращая тем самым развитие болезни. ВОЗ рекомендует проводить интермиттирующую профилактическую терапию сульфадоксином-пириметамином среди беременных женщин, живущих в районах с высокими уровнями передачи инфекции, во время второго и третьего триместров. Детям грудного возраста, живущим в районах с высокими уровнями передачи инфекции, также рекомендуется предоставлять 3 дозы интермиттирующей профилактической терапии СП в рамках регулярной вакцинации.
Устойчивость к инсектицидам
Имеющиеся на сегодняшний день успехи в области борьбы с малярией достигнуты, в основном, в результате борьбы с переносчиками. Борьба с переносчиками в значительной мере опирается на использование пиретроидов (используемых в инсектицидах), которые являются единственным классом инсектицидов, используемым для пропитывания рекомендуемых в настоящее время ОИС и СИДД. К пиретроидам появляется устойчивость, в частности в Африке, хотя на сегодняшний день зафиксировано лишь один-два случая, в которых борьба с переносчиками явно не увенчалась успехом.
В настоящее время не имеется альтернативных, эффективных по стоимости и безопасных инсектицидов. Разработка новых, альтернативных инсектицидов является высоким приоритетом, но дорогостоящим и длительным делом. Особенно высоким приоритетом является разработка новых инсектицидов для пропитывания сеток.
Выявление устойчивости к инсектицидам должно быть неотъемлемой частью всех национальных усилий по борьбе с малярией, направленных на обеспечение применения самых эффективных методов борьбы с переносчиками. Выбор инсектицида для РИОДВП должен быть всегда основан на местных последних данных о чувствительности целевых переносчиков.
Последствия для экономики и систем здравоохранения
Малярия приводит к значительным экономическим убыткам и может уменьшать валовой внутренний продукт (ВВП) в странах с высокими уровнями передачи инфекции на целых 1,3%. Накопленные за длительное время совокупные ежегодные убытки привели к значительным различиям в ВВП между странами, охваченными малярией, и странами, свободными от нее, особенно в Африке.
Расходы здравоохранения на малярию включают как личные, так и государственные расходы на профилактику и лечение. В некоторых странах с тяжелым бременем малярии на эту болезнь приходится:
до 40% расходов общественного здравоохранения;
от 30% до 50% случаев госпитализации;
до 60% амбулаторных обращений в клиники.
Малярия непропорционально поражает неимущих людей, которые не в состоянии оплачивать лечение или имеют ограниченный доступ к медицинской помощи. Эта болезнь способствует дальнейшему погружению в нищету отдельных семей и сообществ.
Ликвидация
Многие страны, особенно в умеренных и субтропических зонах, добились успехов в ликвидации малярии. Глобальная кампания по ликвидации малярии, объявленная ВОЗ в 1955 году, привела к успешной ликвидации этой болезни в некоторых странах, но в конечном итоге не достигла своей всеобщей цели: вместо нее менее чем через два десятилетия была поставлена менее амбициозная цель в области борьбы с малярией. Однако в последние годы вновь появился интерес к ликвидации малярии в качестве долгосрочной цели.
Благодаря широкомасштабному проведению рекомендуемых ВОЗ стратегий, использованию имеющихся в настоящее время методик, сильной национальной приверженности и координированным усилиям партнеров все большее число стран, особенно стран с низким и неустойчивым уровнем передачи малярии, сможет добиться успехов на пути ликвидации малярии.
В последние годы четыре страны добились ликвидации малярии и получили сертификацию Генерального директора ВОЗ: Объединенные арабские эмираты (2007 г.), Морокко (2010 г.), Туркменистан (2010 г.) и Армения (2011 г.).
Вакцины от малярии
В настоящее время лицензированных вакцин от малярии или от каких-либо других паразитов человека нет. На наиболее продвинутых стадиях исследования находится вакцина против P. falciparum, известная как RTS,S/AS01. В настоящее время эта вакцина оценивается в рамках крупного клинического испытания в 7 странах Африки. Результаты этого испытания будут поступать в три этапа, и каждая серия результатов будет рецензироваться внешними консультативными комитетами ВОЗ. Рекомендации ВОЗ по использованию будут зависеть от окончательных результатов этого крупномасштабного клинического испытания. Ожидается, что окончательные результаты будут получены в 2014 году. Другие вакцины против малярии находятся на ранних стадиях исследования.
Деятельность ВОЗ
Глобальная программа ВОЗ по малярии отвечает за разработку курса борьбы с малярией и ее ликвидации путем:
формирования основанной на фактических данных политики и разработки стратегии;
независимой оценки глобального прогресса;
разработки подходов для создания потенциала, укрепления систем и проведения эпиднадзора;
выявления угроз для борьбы с малярией и ее ликвидации, а также новых направлений деятельности.
ВОЗ также является одним из основателей партнерства "Обращение вспять малярии", базирующегося в ВОЗ, которое представляет собой глобальную структуру для проведения координированных действий против малярии. Это партнерство мобилизует действия и ресурсы и способствует достижению консенсуса между партнерами. В его состав входит более 500 партнеров, включая эндемичные по малярии страны, партнеров в области развития, частный сектор, неправительственные организации и организации на уровне отдельных сообществ, фонды, а также научные и учебные институты.
Вопрос №19-21
Токсоплазма
Материал из Википедии — свободной энциклопедии
Токсоплазма |
|||||||||||||||||||
|
|||||||||||||||||||
Научная классификация |
|||||||||||||||||||
промежуточные ранги[показать]
|
|||||||||||||||||||
Международное научное название |
|||||||||||||||||||
Toxoplasma Nicolle & Manceaux, 1908 |
|||||||||||||||||||
|
|||||||||||||||||||
|
Токсоплазма (лат. Toxoplasma) — монотипный род паразитических протозоев, включающий, видимо, один вид — Toxoplasma gondii. Основные хозяева токсоплазм — представители семейства кошачьих. В качестве промежуточных хозяев выступают различные виды теплокровных животных, в том числе и люди. Токсоплазмоз, болезнь, вызываемая токсоплазмой, обычно протекает у человека легко. Однако для плода, в случае если мать заразилась токсоплазмозом во время беременности, а также для человека или кошки с пониженным иммунитетом эта болезнь может иметь серьёзные последствия, вплоть до летального исхода. Toxoplasma gondii принадлежит к типуApicomplexa и является единственным описанным видом рода Toxoplasma. Тем не менее, высказывалась гипотеза, что на самом деле может существовать несколько видов токсоплазм[1].
|
Жизненный цикл Toxoplasma gondii состоит из двух фаз. Половая часть жизненного цикла проходит только в особях некоторых видов семейства кошачьих (дикие и домашние кошки), которые становятся первичным хозяином паразитов. Бесполая часть жизненного цикла может проходить в любом теплокровном животном, например, в млекопитающих (и в кошках тоже) и в птицах.
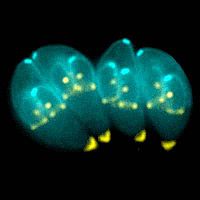
T. gondii при создании дочернего клеточного каркаса в материнской клетке.
В этих промежуточных хозяевах паразит вторгается в клетки, формируя так называемые межклеточные паразитофорные вакуоли, содержащие брадизоиты, медленно воспроизводящиеся формы паразита[2]. Вакуоли формируют тканевые цисты, в основном, в мышцах и в мозге. Так как паразит находится внутри клеток, то иммунная система хозяина не может обнаружить эти цисты. Сопротивляемость к антибиотикамразлична, но цисты очень трудно вывести из организма полностью. Внутри этих вакуолей T. gondiiразмножается последовательностью делений на две части до тех пор, как инфицированная клетка в конце концов не лопается и тахизоиты не выходят наружу. Тахизоиты подвижны и бесполым способом размножаются, производя новых паразитов. В отличие от брадизоитов, свободные тахизоиты легко устраняются иммунной системой хозяина, но при этом могут заразить клетки и сформировать брадизоиты, тем самым поддерживая инфекцию.
Тканевые цисты проглатываются кошкой (например, когда она съедает заражённую мышь). Цисты выживают в желудке кошки, и паразиты заражают эпителиальные клетки тонкой кишки, где они приступают к половому размножению и формированию ооцист. Ооцисты выходят наружу с фекалиями. Животные (в том числе, люди) проглатывают ооцисты (например, поедая немытые овощи и т. д.) или тканевые цисты (в плохо приготовленном мясе) и заражаются. Паразиты внедряются в макрофаги в кишечном тракте и через кровь распространяются по телу.

Структура тахозоита Toxoplasma gondii
Заражение токсоплазмой в острой стадии может быть бессимптомным, но часто вызывает симптомы гриппа на раннеострых стадиях, и, как и грипп, может в редких случаях привести к смерти. Острая стадия спадает за период от нескольких дней до месяцев, переходя в хроническую стадию. Хроническая инфекция обычно бессимптомна, но в случае иммунноослабленных пациентов (а также пациентов, заражённых ВИЧ, или пациентов, проходящих иммунноподавляющую терапию после пересадки органов) токсоплазмоз может развиваться. Наиболее частым проявлением токсоплазмоза у иммунноослабленных пациентов является токсоплазмозный энцефалит, который может привести к смерти. Если заражение T. gondii возникает впервые во время беременности, то паразит может проникнуть через плаценту, заразить плод, что может привести кгидроцефалии, внутричерепному обызвествлению или к хориоретиниту, а также к самопроизвольному аборту или внутриутробной смерти.
Изменение поведения хозяина
Основная статья: Токсоплазмоз
Было доказано, что паразит может влиять на поведение хозяина: заражённые крысы и мыши меньше боятся кошек; замечены факты того, что заражённые крысы сами ищут места, где мочилась кошка. Этот эффект благоприятен для паразита, который сможет размножаться половым способом, если его хозяин будет съеден кошкой[3]. Механизм этого изменения ещё до конца не изучен, но существуют доказательства того, что токсоплазмоз повышает уровень дофамина у заражённых мышей.
Изменения личности человека
Проводя биологические параллели между мышами и людьми, можно предположить, что поведение человека тоже меняется в некоторых случаях. Фактически, наблюдаются взаимосвязи между скрытым заражением токсоплазмой и некоторыми из следующих характеристик:[4]
Повышенная рискованность человека
Более медленные реакции
Бо́льшая вероятность попасть в аварию
Чувство ненадёжности, тревоги и самосомнения
Невротизм
Среди мужчин наблюдался меньший интерес к новизне
Среди женщин наблюдалась бо́льшая откровенность и чистосердечность
«В популяциях, где этот паразит очень распространён, массовые личностные изменения могут приводить к изменениям в их культуре. [Вариации в распространённостиToxoplasma gondii] могут объяснить реально существующие пропорции в различиях среди человеческих популяций, которые мы можем наблюдать с точки зрения культуры: эго, деньги, материальная собственность, работа и законы». (С) Kevin Lafferty, Cat parasite may affect cultural traits in human populations
Роль токсоплазмы в шизофрении
Существует несколько независимых наблюдений, подтверждающих роль заражения токсоплазмой в случаях проявления шизофрении и паранойи[5]:
Острая инфекция токсоплазмы иногда ведёт к психотическим симптомам, не отличающимся от шизофрении.
Некоторые антипсихотические медицинские препараты, используемые для лечения шизофрении (например, галоперидол), также останавливают развитие токсоплазмы в клеточных культурах.
Несколько исследований нашли значительно повышенные уровни антител к токсоплазме у пациентов, больных шизофренией, по сравнению со всем остальным населением.[6]
Заражение токсоплазмой ведёт к повреждению астроцитов в головном мозге, точно такие же повреждения астроцитов наблюдаются при шизофрении.
Активным исследователем роли токсоплазмы и других инфекций при шизофрении является американский психиатр Фуллер Тори.
Распространённость заболевания у людей
У 33,1 % жителей США старше 12 лет были найдены специфичные для токсоплазмы антитела IgG, указывающие на то, что они были когда-либо заражены токсоплазмой (цифры из исследований 1999—2000 годов).[7]
Предполагают, что во всём мире до 65 % всего человечества заражено паразитами Toxoplasma gondii. Но при этом процент заражения сильно различается в разных странах, от 22 % вВеликобритании до более 88 % (или 45 % в зависимости от исследования) во Франции[8], при этом в Южной Корее уровень заражения лишь 4,3 %, а в Бразилии — свыше 66,9 %.[4]
Токсоплазмоз. История изучения. Цикл развития Toxoplasma gondii. |
28-12-2011 |
Токсоплазмоз - паразитарная широко распространенная инфекция человека и позвоночных животных, которая характеризуется чрезвычайным полиморфизмом клинических проявлений в случаях манифестной формы болезни и возможностью длительного хронического носительства.
Важное социальное значение этой инфекции определяется тем, что в связи с возможностью трансплацентарного пути передачи она занимает одно из ведущих мест среди инфекционных агентов перинатальной патологии группы TORCH-инфекций, являясь причиной тяжелых врожденных заболеваний детей и снижения рождаемости.
Повышенный интерес к проблеме токсоплазмоза в настоящее время связан также с его ролью в качестве оппортунистического паразитоза при ВИЧ-инфекции в развитии ее конечной фазы - СПИДа. На фоне вызванного ВИЧ-иммунодефицита латентно протекающий токсоплазмоз обостряется и дает диссеминирующую инфекцию с поражением прежде всего центральной нервной системы в терминальной фазе, так называемого нейро-СПИДа.
История изучения. Возбудитель токсоплазмоза Toxoplasma gondii был обнаружен впервые в 1908 г. одновременно французскими исследователями Николем и Мансо (Nicoll et Manceaux) в Тунисе у североафриканского грызунаChenodactylus gondii и Сплендором (Splendore) в Бразилии у кроликов. Форма паразита (полумесяц, долька апельсина) положена в основу родового названия - toxon по-гречески - арка, дуга, видовое - gondii связано с названием хозяина - грызуна.
Первые сведения о возможной патогенной роли токсоплазм для человека связаны с работами A. Castellani(1913, 1914 гг.) на Цейлоне и А. И. Федорович (1916 г.) в России, которые обнаруживали паразитов, подобных токсоплазмам, при исследовании мазков селезенки и крови на малярию.
Достоверное описание токсоплазмоза у человека было сделано чешским офтальмологом Янку (Janky, 1923 г.), который наблюдал случай тяжелой патологии у новорожденного, погибшего с явлениями гидроцефалии, левостороннего микрофтальма, двусторонней колобомы желтого пятна. При микроскопическом исследовании срезов оболочек глаза были обнаружены паразиты, аналогичные ранее описанным у животных.
В Украине изучение разных сторон проблемы токсоплазмоза связано с именами А. К. Коровицкого, А. Е. Григорашенко, М. Н. Мельника, А. Г. Папа. А. С. Сокол, И. И. Грищенко, Н. И. Шпака и др.
Этиология и цикл развития возбудителя. Возбудитель токсоплазмозаToxoplasma gondii относится к подцарству Protozoa, типу Apicomplexa, классуSporozoa, подклассу Coccidia, отряду Eucoccidiida, подотряду Eimerina.
Токсоплазмы - условно-патогенные простейшие с внутриклеточным образом паразитирования распространены на всех материках, в странах с различными климато-географическими условиями. Это можно объяснить наличием широкого круга хозяев среди сотен видов млекопитающих и птиц, а также способностью возбудителя паразитировать в клетках тканей фактически всех органов. По меткому определению Т. В. Бейр и А. Я, Лысенко (1984 г.), токсоплазма - уникальный паразит, для которого характерны убиквитарность, поликсенность и пантропизм.
Циркуляцию токсоплазм в природе обеспечивают два хозяина - окончательный и промежуточный.
Окончательными хозяевами - хранителями возбудителя в природе, у которых идет половой процесс развития (кишечная фаза), являются представители семейства кошачьих (Felidae), в дикой природе - это дикая кошка, снежный барс, рысь, ягуар, оцелот, бенгальский тигр, в синантропном очаге - домашняя кошка, которая по эпидемиологическому значению стала в центр проблемы, как важный для человека источник инфекции.
Бесполое развитие токсоплазм (внекишечная, тканевая фаза) проходит в органах промежуточных хозяев: домашних животных и диких млекопитающих, птиц и человека.
В природных очагах круг промежуточных хозяев включает почти все обследованные виды млекопитающих и птиц, в условиях синантропных очагов - домашних, сельскохозяйственных животных, птиц, грызунов.
В процессе реализации жизненного цикла (две фазы) возбудитель проходит такие основные стадии развития: эндозоит (тахизоит), псевдоциста, тканевая циста и ооциста (зигоциста).
Эндозоит по форме напоминает дольку апельсина, полумесяц с одним заостренным, а другим закругленным концом. Размеры его варьируют от 4 - 7 мкм в длину и 2 - 4 мкм в ширину. При окраске по Романовскому - Гимзе цитоплазма окрашивается в голубые тона, ядро - в рубиново-красные. Эндозоиты подвижны, способны активно проникать в клетку ткани любого органа. Внутри инвазированной клетки идет быстрое размножение паразита путем продольного деления или внутреннего почкования (эндодиогонии). Такая пораженная клетка со скоплением в ее цитоплазме эндозоитов называетсяпсевдоцистой.
В стадии эндозоита токсоплазмы погибают при нагревании до 55 °С в течение 5-10 минут, при воздействии 50% спирта, 1% фенола, 2% хлорамина. На простых средах не растут. Их можно культивировать на куриных эмбрионах, культуре ткани, а также на лабораторных животных (белых мышах, хомяках и др.).
Тканевая циста достигает размеров от 50 до 100 мкм. Она имеет собственную оболочку, непроницаемую для антител, в ней также идет процесс эндодиогении с образованием брадизоитов. Тканевые цисты сохраняют жизнеспособность многие годы, возможно, на протяжении всей жизни хозяина.
Ооциста - конечная стадия развития токсоплазмы в кишечнике кошки, которая с испражнениями выделяется во внешнюю среду. Зрелая ооциста имеет размеры 10 - 12 мкм в диаметре, она содержит 2 спороцисты с 4-мя спорозоитами в каждой.
Все перечисленные стадии развития токсоплазм являются инвазивными, однако большей активностью обладают ооцисты и тканевые цисты.
Кишечная фаза. Кошки заражаются пероральным путем при поедании тканей промежуточного хозяина, в которых содержатся любые стадии токсоплазмы (эндозоиты, псевдоцисты, тканевые цисты), а также при проглатывании ооцист, выделенных на почву с испражнениями инвазированной токсоплазмами кошки.
В эпителиальных клетках слизистой кишечника животного проходит процесс шизогонии с образованием мерозоитов, а в дальнейшем - гаметогонии с образованием макро- и микрогамет. При их слиянии формируются ооцисты, выделяющиеся с фекалиями во внешнюю среду. За 2 - 5 дней ооциста в почве дозревает, становится инвазивной и сохраняет жизнеспособность до 18 месяцев.
У кошки - окончательного хозяина - в каждом случае заражения параллельно с половой фазой проходит и бесполое развитие, как у промежуточного хозяина -тканевая, или внекишечная, фаза.
Заражение человека или животных - промежуточных хозяев - происходит преимущественно пероральным путем при проглатывании ооцист или при употреблении в пищу мяса инвазированных животных. При разрушении ооцист, тканевых цист в пищеварительном канале человека освободившиеся эндозоиты проникают в клетки слизистой кишечника и по лимфатическим и кровеносным путям распространяются в другие органы и ткани, продолжая развитие до образования псевдоцист.
Длительность развития одной генерации эндозоитов составляет 5 часов. За это время из одной образуется 12-32 дочерних особей.
При стихании острого процесса, при хроническом токсоплазмозе на фоне развивающегося иммунитета образуются тканевые цисты, покрытые собственной оболочкой, непроницаемой для антител. Образовавшись внутри клетки, после ее гибели тканевые цисты располагаются внеклеточно, чаще всего в головном мозге, оболочках глаза, скелетных мышцах, мышце сердца, матки. Со временем они обызвествлятся.
В то же время при длительном сохранении, при изменении условий (иммунодепрессия) возможно эксцистирование и освобождение брадизоитов, которые проникают в клетки, размножаются и вызывают рецидив болезни.
Жизненный циклтоксоплазмы осуществляется потрем путям (А. Я. Лысенко), которые могут проходить независимо друг от друга:
кошка - внешняя среда - кошка;
кошка - внешняя среда - теплокровное животное - кошка;
теплокровное животное - теплокровное животное.
Оптимальным путем для развития и сохранения возбудителя в природе является второй, в котором участвуют обе фазы - кишечная (половая) у окончательного хозяина - кошки, и тканевая (бесполая) у промежуточных хозяев.
Токсоплазмоз — паразитарное заболевание человека и животных, вызываемое токсоплазмами Toxoplasma gondii. Источник инвазии — различные виды (свыше 180) домашних и диких млекопитающих (кошки, собаки, кролики; хищники, травоядные, грызуны ) Пути заражения
Заражение человека происходит при употреблении мясных продуктов и яиц, не прошедших достаточную термическую обработку. Не исключена возможность заражения при попадании возбудителя на слизистые оболочки и повреждённые кожные покровы, трансмиссивным (см. Трансмиссивные болезни) и др. путём. Наблюдается и внутриутробное заражение. Факторы, которые могут способствовать появлению в организме паразита и повышают риск возникновения токсоплазмоза:
Общение с заражёнными животными
Использование в быту не мытых после уборки кошачьего туалета или любого другого контакта с кошачьими экскрементами рук.
Употребление пищу сырого или не до конца приготовленного мяса, особенно свинины, мяса ягнёнка или оленины.
Контакт с сырым или непрожаренным (непроваренным) мясом.
Пересадка органов или переливание крови (очень редко).
Наличие токсоплазмоза у родителей.
Клиническая картина
Различают врождённый и приобретённый (острый и хронический) токсоплазмоз. При врождённом токсоплазмозе наблюдаются гибель плода в утробе матери, смерть новорождённого в результате общей инфекции или (у оставшихся в живых) поражение нервной системы, глаз и др. органов.
Острая приобретённая форма протекает как тифоподобное заболевание (с высокой температурой, увеличением печени, селезёнки) либо с преимущественным поражением нервной системы (головная боль, судороги, рвота, параличи и др.). Чаще токсоплазмоз протекает хронически, с субфебрильной температурой, головной болью, увеличением лимфоузлов и печени, понижением работоспособности; может сопровождаться поражением глаз, сердца, нервной и др. систем и органов. Токсоплазмоз может протекать и в латентной (скрытой) форме.
Диагностика
Основным методом диагностики заболевания является серологический. Выполняется определение уровня иммуноглобулонов G с помощью ИФА или реакции непрямой флюоресценции. Уровень антител достигает максимального уровня через 1—2 месяца после начала заболевания и впоследствии регистрируется неопределённо долго. У пациентов с сероконверсией или четырёхкратным увеличением титра IgG определяют уровень специфических IgM для подтверждения наличия острой инфекции. ИФА является методом выбора при анализе уровня IgM, с его помощью регистрируется рост их концентрации уже через 2 недели после инфицирования. Пик концентрации антител достигается через месяц, исчезают они обычно через 6—9 месяцев, но в отдельных случаях могут периодически обнаруживаться в течение 2 и более лет, затрудняя дифференцировку острой и хронической форм инфекции.
Лечение
Большинство случаев приобретённой инфекции у иммунокомпетентных лиц разрешаются без специфической терапии. При хореоретините или поражении жизненно важных органов назначают комбинацию пириметамина (Дараприм) с сульфадиазином. Альтернативой может быть комбинация пириметамина с клиндамицином при плохой переносимости
сульфадиазина. При лечении хореоретинита и поражений ЦНС применяют глюкокортикоиды. ВИЧ-инфицированные пациенты с энцефалитом должны получать пожизненную супрессивную терапию для предотвращения рецидива инфекции.
При выраженной и бессимптомной врождённой инфекции в качестве начальной терапии рекомендуется комбинация пириметамина с сульфадиазином и фолиевой кислотой. Терапия, как правило, длительная, порой до 1 года. Лечение токсоплазмоза, возникшего во время беременности, в том числе и у ВИЧ-инфицированных женщин, следует проводить спирамицином. При заражении женщины в третьем триместре или инфицировании плода после 17 недель гестации используется комбинация пириметамина с сульфадиазином [2].
Показана высокая активность телитромицина in vitro в отношении Т. gondii (M. Kilinc, M. Hokelek, M. Erturk) [1].
В исследованиях на животных показано, что атоваквон в сочетании с пироллидина дитиокарбиматом вызывают конверсию тахизоитов в стадию тканевых цист (O. Djurkovic-Djakovic, A. Nikolic, B. Bobic, I. Klun) [1].
На данный момент (2010 год) токсоплазмоз лечат кларитромицином 500 мг один раз в сутки в течение 14 дней и однократно флуконазолом 150 мг на пятнадцатый день.





 Лейшмания
(1)
в клетках кожи (2)
у человека
или грызуна
Лейшмания
(1)
в клетках кожи (2)
у человека
или грызуна
 Лейшмания
(3)
в моските
Лейшмания
(3)
в моските
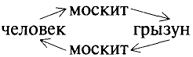
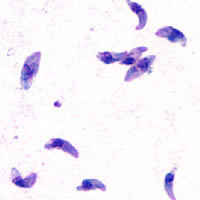 Тахизоиты Toxoplasma
gondii
Тахизоиты Toxoplasma
gondii