
- •Предмет физики. Методы физический исследований: опыт, гипотеза, эксперимент, теория.
- •Предмет механики. Кинематика и динамика. Основные единицы международной системы единиц механики(си).
- •Физические модели: материальная точка, системы материальных точек, абсолютно твёрдое тело, сплошная среда(кинематика).
- •Три способа кинематического описания движения материальной точки: векторный, координатный и естественный способ задания движения точки.
- •Скорость и ускорение материальной точки. Виды и характер движения точки.
- •Кинематика абсолютно твёрдого тела: простейшие виды движения тела, взаимосвязь между линейными и угловыми характеристиками при вращательном движении.
- •Сложное движение: динамика.
- •Основная задача динамики: прямая и обратная задача динамики.
- •Важнейшие понятия динамики материальной точки: инертность, масса, импульс, масса, сила.
- •Меры действия силы и динамические меры механического движения: момент силы, работа и мощность силы, момент импульса. Кинетическая энергия.
- •Законы изменения момента импульса и кинетической энергии материальной точки. Уравнение моментов, взаимосвязь между изменением кинетической энергии материальной точки и работой сил.
- •Явление трения скольжения, качения и вязкого сопротивления: внешнее и внутреннее трение. Трение покоя и трение скольжения. Трение качения. Вязкое трение.
- •Сила упругости. Закон Гука: виды деформации тела.
- •Закон всемирного тяготения. Энергия. Закон сохранения энергии в механике.
- •Потенциальная энергия консервативных сил: потенциальная энергия и её связь с работой консервативных сил.
- •Абсолютно упругий/неупругий центральный удар.
- •Взаимосвязь между потенциальной энергией и силой взаимодействия: сила – градиент потенциальной энергии. Понятия потенциальной ямы и потенциального барьера.
- •Потенциальное поле. Характеристики и свойства гравитационного поля. Принцип суперпозиции полей.
- •Неинерциальная система отсчёта: силы инерции, второй закон ньютона в неинерциальной системе, динамика абсолютно твёрдого тела.
- •29. Гармонический осциллятор. Примеры: Пружинный, математический, физический маятники.
- •30. Представление колебаний в виде векторов.
- •31. Сложение колебаний одного направления и перпендикулярных колебаний.
- •32. Свободные затухающие колебания и их характеристики. Затухание свободных колебаний
- •33. Вынужденные колебания. Резонансные кривые.
- •34. Распространение волн в упругой среде. Продольные и поперечные волны
- •35. Уравнение бегущей волны. Фазовая и групповая скорости.
- •36. Энергетические характеристики волны. Плотность потока энергии волны.
- •37. Стоячие волны. Эффект Доплера.
- •38. При́нцип относи́тельности Эйнштеина. Инвариантность скорости света
- •39. Замедление времени и сокращение длин
- •40. Преобразования Лоренса в сто
- •43 Общие свойства жидкостей и газов
- •44 Уравнение неразрывности
- •45 Уравнение Бернулли
- •46 Вязкость. Ламинарные и турбулентные режимы течения
- •47. Термодинамический и статистический методы
- •48. Изопроцессы идеального газа
- •49. Основное уравнение молекулярно-кинетической теории идеальных газов. Молекулярно-кинетический смысл температуры
- •52 Теплоемкость. Классическая теплоемкость идеального газа и ее недостатки
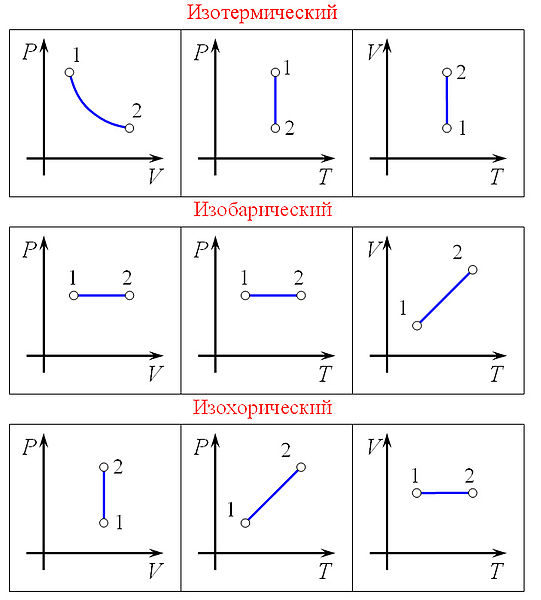
48. Изопроцессы идеального газа
Изобарный
процесс — процесс
изменения состояния термодинамической
системы при постоянном давлении (P =
const)
![]()
Изохорный—
процесс
изменения состояния термодинамической
системы при постоянном объёме (V = const).
Для идеальных газов изохорический
процесс описывается законом Шарля: для
данной массы газа при постоянном объёме,
давление прямо пропорционально
температуре:
![]()
Изотермический процесс — процесс изменения состояния термодинамической системы при постоянной температуре (T = const)(PV = const). Изотермический процесс описывается законом Бойля — Мариотта:При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Адиабатный процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:pV^γ = const
где γ — показатель адиабаты, определяемый типом газа.
49. Основное уравнение молекулярно-кинетической теории идеальных газов. Молекулярно-кинетический смысл температуры
Основное уравнение МКТ:
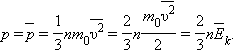
50. Внутреняя энергия как функция состояния. Работа газа количество теплоты.
Внутренняя энергия идеального газа.
Вну́тренняя
эне́ргия
тела (обозначается как E
или U) —
это сумма энергий молекулярных
взаимодействий и тепловых движений
молекулы. Внутренняя энергия является
однозначной функцией состояния системы.
Это означает, что всякий раз, когда
система оказывается в данном состоянии,
её внутренняя энергия принимает присущее
этому состоянию значение, независимо
от предыстории системы. Следовательно,
изменение внутренней энергии при
переходе из одного состояния в другое
будет всегда равно разности между ее
значениями в конечном и начальном
состояниях, независимо от пути, по
которому совершался переход.
![]()
Работа
газа. Теплопередача и количество теплоты.
Теплоёмкость.
![]() -
работа газа.
Теплоёмкостью какого-либо
тела называется величина, равная
количеству тепла, которое нужно сообщить
телу, чтобы повысить его температуру
на один градус.
Подобно тому как
количество энергии, переданное одним
телом другому, определяется работой А,
совершаемой друг над другом телами,
количеством энергии, переданное от тела
к телу путём теплопередачи, определяется
количеством теплоты Q,
отданного одним телом другому.
Первое
начало термодинамики и его применение
к изопроцесасм. Теплоёмкость идеального
газа.
Первое
начало термодинамики:
количество тепла, сообщённое системе,
идёт на приращение внутренней энергии
системы и на совершение системой работы
над внешними телами.
-
работа газа.
Теплоёмкостью какого-либо
тела называется величина, равная
количеству тепла, которое нужно сообщить
телу, чтобы повысить его температуру
на один градус.
Подобно тому как
количество энергии, переданное одним
телом другому, определяется работой А,
совершаемой друг над другом телами,
количеством энергии, переданное от тела
к телу путём теплопередачи, определяется
количеством теплоты Q,
отданного одним телом другому.
Первое
начало термодинамики и его применение
к изопроцесасм. Теплоёмкость идеального
газа.
Первое
начало термодинамики:
количество тепла, сообщённое системе,
идёт на приращение внутренней энергии
системы и на совершение системой работы
над внешними телами.
![]() при
изобарном процессе
при
изобарном процессе
![]() при
изохорном процессе (A =
0)
при
изохорном процессе (A =
0)
![]() при
изотермическом процессе (ΔU =
0)
A=-∆U
– при адиабатном процессе
при
изотермическом процессе (ΔU =
0)
A=-∆U
– при адиабатном процессе
Теплоёмкостью какого-либо тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус. Подобно тому как количество энергии, переданное одним телом другому, определяется работой А, совершаемой друг над другом телами, количеством энергии, переданное от тела к телу путём теплопередачи, определяется количеством теплоты Q, отданного одним телом другому.
