
- •31. Электрический ток в электролитах.
- •32. Электролиз.
- •33. Электропроводные потенциалы.
- •34. Опыты Эрстеда и Ампера. Сила Лоренца.
- •40. Намагничивание в-ва.
- •35. Магнитное поле электрических токов.
- •36. Действие магнитных полей на эл. Токи.
- •37. Магнитный диполь.
- •38. Релятивистский хар-р магнитного поля. Теорема Гаусса.
- •39. Теорема о Циркуляции вектора магнитной индукции.
- •41. Напряжённость магнитного поля.
- •42. Магнитное поле на разделе 2-х магнетиков.
- •43. Механизмы намагничивания магнетика.
- •51. Переходные процессы в цепи с ёмкостью.
- •52.Переходные процессы в цепи с индуктивностью.
- •53. Свободные незатухающие электромагнитные колебания.
- •54. Свободные затухающие электромагнитные колебания.
- •55. Вынужденные гармонические колебания.
- •60. Волновое движение.
31. Электрический ток в электролитах.
Эл. током назыв. растворы, в которых растворённое в-во разделяется на составные части при протекании через них эл. тока.
Эл. ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей кислот и щелочей в результате расщепления части нейтральных молекул.
Рекомбинация происходит главным образом в ионизованных газах и плазме и приводит к практически полному исчезновению заряженных частиц при отсутствии противодействующих ей факторов. Процесс расщепления молекул растворяемых в-в на ионы в результате взаимодействия с растворителем назыв. электролитической диссоциацией.
З-н
Освальда: соотношение выражающее
зависимость эквивалентной электропроводности
разбавленного раствора слабого
электролита от концентрации раствора
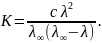
Коэффициент
эл. диссоциации:
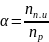 (пар. ионов/раствора).
(пар. ионов/раствора).
Проводимость
электролитов:
 где z-валентность
метала.
где z-валентность
метала.
32. Электролиз.
При прохождение тока через электроны на электродах, которые служат для подачи напряжения, выделяются продукты электрохимической реакции, т.е. наблюдается явление электролиза.
1 з-н Фарадея гласит, что масса выделившегося на электроде в-ва прямо пропорциональна прошедшему через электроны заряду, т.е m=kq, где k-электрохимический эквивалент в-ва.
2
з-н Фарадея утверждает, что электрохимические
эквиваленты в-ва пропорциональны их
химическим эквивалентам.
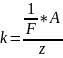 ,
где А-атомная масса, z-его
валентность, F-постоянная
Фарадея.
,
где А-атомная масса, z-его
валентность, F-постоянная
Фарадея.
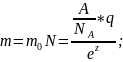
 объединённый
з-н Фарадея.
объединённый
з-н Фарадея.
33. Электропроводные потенциалы.
Электродный потенциал – разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Химические источники тока: аккумуляторы, топливные элементы, воздушно-цинковый элемент. Химический источник тока – такой источник тока, в котором энергия протекающих в нём химических реакций, непосредственно превращается в электрическую энергию. Основу химических источников составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов – электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции.
34. Опыты Эрстеда и Ампера. Сила Лоренца.
1820 – Эрстед описал опыт и продемонстрировал его (компас). Проводник с током оказывает действие на магнитную стрелку, а магнит действует на проводник.
Опыт
Ампера это два проводника, по которым
течёт ток в одном направлении,
притягиваются и наоборот. Он показал,
что магнит действует на проводник с
током. Проводник выталкивается из
магнита. Опыт показывает, что сила
действующая на точечный заряд зависит
в общем случае не только от положения
этого заряда, но и от его скорости.
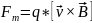 – магнитная сила;
– магнитная сила;
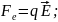
Сила
Лоренца:
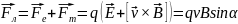 .
.
Направление
силы Лоренца определяем по правилу
правой руки. Магнитная индукция
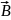 - векторная величина, являющаяся силовой
характеристикой магнитного поля в
данной точке пространства. Показывает,
с какой силой магнитное поле действует
на заряд, движущийся со скоростью.
- векторная величина, являющаяся силовой
характеристикой магнитного поля в
данной точке пространства. Показывает,
с какой силой магнитное поле действует
на заряд, движущийся со скоростью.
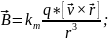
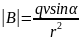 .
.
З-н Ампера: сила действующая на элемент проводника с током со стороны магнитного поля, называемая силой Ампера, равна векторному произведению элемента тока и вектора магнитной индукции:
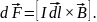
Магнитные силовые линии служат для наглядности, т.к. и электрические силовые линии. Чем гуще силовые линии, во столько раз больше модуль индукции.
