
- •2.Периодический закон менделеева.
- •3.Ядерная модель атома.
- •4. Виды химической связи.
- •7.Понятие о растворах
- •8.Растворы электролитов.
- •9.Комплексные соединения.
- •10.Грубодисперсные системы.
- •11.Водородный электрод.
- •12.Коррозия Ме.
- •13.Вяжущие вещества.
- •14.Керамика.
- •15.Дефекты облицовки зданий.
- •18. Гидрофобизация строительных материалов
- •Методы гидрофобизации строительных материалов и конструкций
- •18.Солевая коррозия кирпичной кладки.
8.Растворы электролитов.
Электролиты – вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Необходимым условием, определяющим возможность процесса электролитической диссоциации, является наличие в растворяемом веществе ионных * или полярных связей *, а также достаточная полярность * самого растворителя *. Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации a и константой диссоциации K.
Степенью
диссоциации (a) электролита называется
отношение числа его молекул, распавшихся
на ионы, к общему числу молекул электролита
в растворе, т. е.
 . Электролиты можно разделить на две
большие группы: сильные и слабые. Сильные
электролиты диссоциируют практически
полностью. К сильным электролитам
относятся, например, H2SO4, HCl, HNO3, H3PO4, HClO3,
HClO4, KOH, а также хорошо растворимые соли:
NaCl, KBr, NH4NO3 и др. Для слабых электролитов
устанавливается равновесие между
недиссоциированными молекулами и
ионами. К слабым электролитам относятся
плохо растворимые соли (см. таблицу
растворимости), вода и большинство
органических кислот (например, уксусная
CH3COOH, муравьиная HCOOH), а также неорганические
соединения: H2CO3, H2S, HCN, H2SiO3, H2SO3, HNO2, HClO,
HCNO, NH4OH и др.
. Электролиты можно разделить на две
большие группы: сильные и слабые. Сильные
электролиты диссоциируют практически
полностью. К сильным электролитам
относятся, например, H2SO4, HCl, HNO3, H3PO4, HClO3,
HClO4, KOH, а также хорошо растворимые соли:
NaCl, KBr, NH4NO3 и др. Для слабых электролитов
устанавливается равновесие между
недиссоциированными молекулами и
ионами. К слабым электролитам относятся
плохо растворимые соли (см. таблицу
растворимости), вода и большинство
органических кислот (например, уксусная
CH3COOH, муравьиная HCOOH), а также неорганические
соединения: H2CO3, H2S, HCN, H2SiO3, H2SO3, HNO2, HClO,
HCNO, NH4OH и др.
Константа равновесия для процесса диссоциации называется константой диссоциации (K). В общем случае для электролита, диссоциирующего на два иона:
АВ=А+ + В–
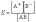
Если обозначить концентрацию электролита, распадающегося на два иона, через C, то
[A+] = [B–] = aC; [AB] = C(1–a);
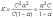
Это уравнение соответствует закону разбавления Оствальда. Если электролит слабый, и диссоциация очень мала (a<<1), то закон разбавления Оствальда упрощается:
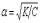
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в воде или при плавлении.
еория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Значение Kd зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения:
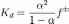
где f — средний коэффициент активности электролита.
Водоро́дный
показа́тель— мера активности ионов
водорода в растворе, и количественно
выражающая его кислотность, вычисляется
как отрицательный (взятый с обратным
знаком) десятичный логарифм активности
водородных ионов, выраженной в молях
на литр: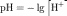
Так как в кислых растворах [H+] > 10−7, то pH кислых растворов pH < 7, аналогично pH щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH-); при понижении температуры, напротив, нейтральная pH возрастает.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв

Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32- + H2O = HCO3- + OН-
(раствор имеет щелочную реакцию, реакция протекает обратимо)
2. Гидролиз соли сильной кислоты и слабого основания:
СuСl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую реакцию, реакция протекает обратимо)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S(газ)
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
