
- •2.Периодический закон менделеева.
- •3.Ядерная модель атома.
- •4. Виды химической связи.
- •7.Понятие о растворах
- •8.Растворы электролитов.
- •9.Комплексные соединения.
- •10.Грубодисперсные системы.
- •11.Водородный электрод.
- •12.Коррозия Ме.
- •13.Вяжущие вещества.
- •14.Керамика.
- •15.Дефекты облицовки зданий.
- •18. Гидрофобизация строительных материалов
- •Методы гидрофобизации строительных материалов и конструкций
- •18.Солевая коррозия кирпичной кладки.
4. Виды химической связи.
Химическая связь — это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. Различают несколько видов связи.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12.
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или
Для ковалентной неполярной, полярной и ионной связи общим является участие в образовании связи внешних электронов, которые еще называют валентными. Различие же состоит в том, насколько электроны, участвующие в образовании связи, становятся общими. Если эти электроны в одинаковой мере принадлежат обоим атомам, то связь ковалентная неполярная; если эти электроны смещены к одному атому больше, чем другому, то связь ковалентная полярная. В случае, если электроны, участвую щие в образовании связи, принадлежат одному атому, то связь ионная.
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
метод валентных связей -метод приближенного решения электронного ур-ния Шрёдингера для многоэлектронных молекулярных систем. Основан на представлениях о двухцентровых хим. связях между атомами в молекуле, образуемых двумя электронами. Эти представления являются обобщением на многоатомные молекулы приближения Гайтлера - Лондона, позволившего впервые с помощью квантовомех. методов объяснить хим. связь в молекуле Н2.
Осн. физ. идея В. с. м. состоит в том, что волновая ф-ция молекулы выражается через волновые ф-ции составляющих ее атомов. Образование хим. связи рассматривается как результат спаривания спинов своб. электронов атомов. Тем самым В. с. м. дает обоснование одному из осн. положений теории валентности: валентность нейтрального атома равна числу своб. электронов в его валентной оболочке. Каждому валентному штриху, соединяющему атомы А и В в структурной ф-ле молекулы, отвечает двухэлектронная ф-ция валентной связи ХАВ(1,2), к-рая представляется в виде произведения двух волновых ф-ций: пространственной Ф(1,2), симметричной относительно перестановки координат электронов, и спиновой(1,2), антисимметричной относительно такой перестановки и описывающей систему двух электронов с противоположными спинами; цифры 1 и 2 в этих обозначениях указывают пространств. координаты или спиновые переменные первого и второго электронов либо те и другие одновременно.
Молекулярные орбитали
Взаимодействие (перекрывание) АО двух (или более) атомов приводит к образованию молекулярных орбиталей (МО), которые заселяются обобществленными электронами, связывающими ядра атомов в молекуле.
Молекулярная орбиталь – область наиболее вероятного пребывания электрона в электрическом поле двух (или более) ядер атомов, составляющих молекулу.
МО подразделяются по двум признакам:
относительно уровня энергии и степени связывания атомов
(связывающие МО, разрыхляющие МО, несвязывающие МО);
по типу (геометрии) перекрывания исходных АО (σ-МО и π-МО).
Метод МО ЛКАО в варианте Хюккеля был разработан для расчета вполне определенного класса соединений — ненасыщенных углеводородов, обладающих системой сопряженных двойных связей. Несмотря на очевидную грубость использованных приближений, в рамках этого метода удалось уже в 1931 году, задолго до появления первых ЭВМ, описать электронное строение полиенов, в частности объяснить ароматичность в циклических полиенах и сформулировать известное правило Хюккеля. Все расчеты молекул, рассмотренные ниже, могут быть выполнены даже без калькулятора.
Специфика строения сопряженных непредельных углеводородов позволяет предположить, что многие их химические свойства определяются электронами π-системы, то есть электронами на орбиталях, антисимметричных относительно плоскости молекулы (а все рассматриваемые системы обязательно имеют такую плоскость!). Можно строго показать, что электроны связей, расположенных в плоскости молекулы, на вид π МО не влияют, и задача нахождения вида и энергий π МО может быть решена отдельно от описания σ-электронов. В таком случае можно считать, что каждый углеродный атом может быть представлен одной-единственной 2рАО, располагающейся перпендикулярно плоскости молекулы, и исключить из рассмотрения атомы водорода. Это приближение (σ—π-приближение) позволяет сильно упростить задачу. Например, для молекулы бензола в σ—π-приближении достаточно рассмотреть 6 МО, построенных из 6 АО, и разместить на них 6 электронов. Полный расчет этой молекулы должен включать 36 АО, из которых следует построить 36 МО и заполнить их 42 электронами.
Следующее приближение заключается во введении в теорию двух параметров: параметра α, описывающего взаимодействие электрона 2р АО атома углерода со своим ядром, и параметра β, характеризующего взаимодействие между двумя соседними атомами углерода, представленными своими 2р АО. Оба эти параметра имеют размерность энергии и отрицательны по величине. Взаимодействием между не связанными непосредственно атомами углерода пренебрегают.
Введенные приближения позволяют свести уравнение Шредингера для молекулы, содержащей n углеродных атомов, к системе n + 1 уравнений, неизвестными в которых являются n коэффициентов сki, квадраты которых с2ki, определяют вклад АО φkв МО ψi, и энергия МО εi,. Полная энергия молекулы в приближении Хюккеля определяется как суммарная энергия всех π-электронов, энергия каждого из π-электронов соответствует энергии занимаемой им МО.
5. Скорость химической реакции – изменение концентрации одного из реагирующих веществ в единицу времени
V x.p = C/t
C (моль/л) – концентрация веществ,
t (с) – время, V. x. p (моль/л) – скорость химической реакции.
Рассматривая кинетику химических реакций, следует иметь в виду, что характер взаимодействия зависит от агрегатного состояния продуктов и реагентов. Продукты и реагенты, вместе взятые, образуют так называемую физико-химическую систему. Совокупность однородных частей системы, обладающих одинаковыми химическими составом и свойствами и отделенных от остальных частей системы поверхностью раздела, называют фазой.Системы, состоящие из одной фазы, называется гомогенными, а системы, содержащие несколько фаз – гетерогенными. Соответственно этому в химии введено понятие о гомогенных и гетерогенных реакций. Реакция называют гомогенной, если реагенты и продукты составляют одну фазу:
HCI+NaOH=NaCL+H2O
При гетерогенной реакции реагенты и продукты находятся в различных фазах:
Zn+2HCL=ZnCL2+H2
В последнем случае, как реагенты, так и продукты составляют различные фазы (Zn твердый, ZnCL2 находится в растворе, а H2 – газ).
Если реакция протекает между веществами в гетерогенной системе, то реагирующие вещества соприкасаются между собой не по всему объему, а только на поверхности. В связи с этим определение скорости гетерогенной реакции следующее:
Факторы, влияющие на скорость реакции
1.Природа реагирующих веществ
2.Концентрация реагирующих веществ.
3. Температура.
Большое влияние на скорость химические реакции оказывает температура
Вант-Гофф
сформулировал правило: повышение
температуры на каждые 10 о С приводит к
увеличению скорости реакции в 2-4 раза
(эту величину называют температурным
коэффициентом реакции).

При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля “активных” молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции.
4. Катализатор
Одно из наиболее эффективных средств воздействия на скорость химических реакций –использование катализаторов. Как вы уже знаете из школьного курса химии, катализаторы – это вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменными как по составу, так и по массе. Иначе говоря, в момент самой реакции катализатор активно участвует в химическом процессе, как и реагенты, но к концу реакции между ними возникает принципиальное отличие: реагенты изменяют свой химический состав, превращаясь в продукты, а катализатор выделяется в первоначальном виде.
Чаще всего роль катализатора заключается в увеличении скорости реакции, хотя некоторые катализаторы не ускоряют, а замедляют процесс. Явление ускорения химических реакций благодаря присутствию катализаторов носит название катализа, а замедления – ингибирования.
Закон действия масс.
Действующих масс закон, один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия. Норвежские учёные К. Гульдберг и П. Вааге, сформулировавшие Д. м. з. в 1864—67, назвали «действующей массой» вещества его количество в единице объёма, т. е. концентрацию, отсюда — наименование закона.
Если в идеальной газовой смеси или идеальном жидком растворе происходит реакция:
аА + а'А' = bB + b'B' (1)
(А, А' и т.д. — вещества, а, а' и т.д. — стехиометрические коэффициенты), то, согласно Д. м. з., скорость реакции в прямом направлении:
r+ = k+ [A] a [A'] a' (2)
Здесь [А] — концентрация вещества А и т.д., k+ — константа скорости реакции (в прямом направлении), k+ зависит от температуры, а в случае жидкого раствора — также и от давления; последняя зависимость существенна лишь при высоких давлениях. Вид уравнения (2) определяется тем, что необходимым условием элементарного акта реакции является столкновение молекул исходных веществ, т. е. их встреча в некотором малом объёме (порядка размера молекул). Вероятность найти в данный момент в данном малом объёме молекулу А пропорциональна [А]; вероятность найти в нём одновременно а молекул А и а' молекул А' по теореме о вероятности сложного события пропорциональна [А] a [А'] a'. Число столкновений молекул исходных веществ в единичном объёме за единичное время пропорционально этой величине. Определённая доля этих столкновений приводит к реакции. Отсюда вытекает уравнение (2)
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Энергия активации— минимальное количество энергии, которое требуется сообщить системе, чтобы произошла реакция.
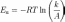
k — константа скорости реакции, A — фактор частоты для реакции, R — универсальная газовая постоянная, T — температура в кельвинах.
катализ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему - газовую или жидкую, между катализатором и реагирующими веществами отсутствует поверхность раздела. Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор - твердое вещество, а реагирующие вещества - газы или жидкости. Примерами могут служить окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля или оксида марганца (IV) (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава, строения и состояния).
6. Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇆ 2NH3
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Все химические реакции, в принципе, обратимы.
Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия.
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Принцип ле-шателье.смещение хим.равновес.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому. N2 + 3H2 2NH3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
kпр×[H2]×[I2]=kоб×[HI]2 или
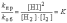
Отношение констант скорости прямой и обратной реакций (K) называется константой равновесия. При постоянной температуре константа равновесия представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов и исходных веществ, которое устанавливается при равновесии. Величина K зависит от природы реагирующих веществ и от температуры.
