
- •2.Периодический закон менделеева.
- •3.Ядерная модель атома.
- •4. Виды химической связи.
- •7.Понятие о растворах
- •8.Растворы электролитов.
- •9.Комплексные соединения.
- •10.Грубодисперсные системы.
- •11.Водородный электрод.
- •12.Коррозия Ме.
- •13.Вяжущие вещества.
- •14.Керамика.
- •15.Дефекты облицовки зданий.
- •18. Гидрофобизация строительных материалов
- •Методы гидрофобизации строительных материалов и конструкций
- •18.Солевая коррозия кирпичной кладки.
1.Закон сохранения массы (Ломоносов, 1748
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна.
Закон постоянства состава(Пруст 1808)
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях
Массовая доля элемента w(Э) показывает, какую часть составляет масса данного элемента от всей массы вещества: где n - число атомов; Ar(Э) - относительная атомная масса элемента; Mr - относительная молекулярная масса вещества.
w(Э) = (n • Ar(Э)) / Mr
Зная количественный элементный состав соединения можно установить его простейшую молекулярную формулу:
1. Обозначают формулу соединения Ax By Cz
2. Рассчитывают отношение X : Y : Z через массовые доли элементов:
w(A) = (х • Ar(А)) / Mr(AxByCz)
X = (w(A) • Mr) / Ar(А)
x : y : z = (w(A) / Ar(А)) : (w(B) / Ar(B)) : (w(C) / Ar(C))
3. Полученные цифры делят на наименьшее для получения целых чисел X, Y, Z.
4. Записывают формулу соединения.
Закон кратных отношений
(Д.Дальтон, 1803 г.)
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
N2O N2O3 NO2(N2O4) N2O5
Число атомов кислорода в молекулах этих соединений, приходящиеся на два атома азота, относятся между собой как 1 : 3 : 4 : 5.
Закон эквивалентов.
Массы(объемы) вещ-в,уч.в хим.реакции отно.как их Эм(Эv)
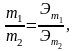
Эквивалентной массой(объемом)называется масса(объем)одного эквивалента вещ-ва.
Эквивалент-это кол-во вещ-ва,которое в хим.рекции присоед.или замещ.1 моль атомов водорода.
Закон Авогадро
Закон Авога́дро —в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т.е. при 0° С (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л/моль. Этот объём называют молярным объёмом газа Vm.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
2.Периодический закон менделеева.
Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса.
Современная формулировка:
свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов.
Физический смысл химической периодичности
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН3) - основания, VI и VII групп (Н2Э и НЭ) - кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус - по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации - по периоду возрастает, а в подгруппе уменьшается; электроотрицательность - по периоду увеличивается, а в подгруппе уменьшается.
По положению элемента в периодической системе можно прогнозировать его основные свойства как средние всех его соседей:
Для характеристики химического элемента по периодической системе Д.И.Менделеева следует рассмотреть:
1.Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа; атомная масса).
2. Строение атома (заряд ядра; состав ядра - количество протонов p11, нейтронов n01 и электронов ē; число энергетических уровней и подуровней; написать формулу электронной конфигурации; квантовые ячейки; по числу и характеру валентных электронов определить тип элемента).
3. Формулы и химический характер соединений (высшего оксида и гидроксида; водородных соединений).
4.Сравнить с соседями (по периоду, по группе).
Порядковый номер 34 имеет селен Se. Элемент находится в IV периоде, значит в атоме имеется 4 энергетических уровня. Он находится в главной подгруппе VI группы; его валентные электроны распределены на 4s и 4p-подуровнях.
Электронная формула селена:
34Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
Внешний уровень в виде квантовых ячеек имеет вид:
Атом селена имеет 6 валентных электронов; поэтому высшая валентность равна 6, что соответствует номеру группы.
Селен - p- элемент, поэтому будет проявлять свойства неметалла.
Высший оксид SeO3, его гидроксид H2SeO4 и газообразное водородное соединение H2Se имеют кислотный характер.
Закон мозли.
Положительный заряд ядра атома равен порядковому номеру эл.в период.ситст.
