
- •Волновая функция
- •Квантово-механическая модель атома
- •Периодические свойства химических элементов
- •Основные оксиды
- •[Править]Кислотные оксиды
- •]Амфотерные оксиды
- •[Править]Получение
- •Кислоты
- •Классификация
- •Получение
- •Химические свойства
- •Основания
- •Получение
- •Химические свойства
- •Классификация
- •Средние соли Получение
- •Химические свойства
- •Получение
- •Химические свойства.
- •[Править] Примеры
- •Количество энтальпии
- •13 Второй закон термодинамики. Энтропия.Энергия Гиббса как критерий вероятности самопроизвольного протекания процесса.
- •Принцип Ле Шателье
- •Донорно-акцепторная связь
- •Метод валентных связей
- •Молекулярность и порядок реакции
- •Температурный коэффициент скорости реакции
- •Термодинамика процесса растворения
- •Коллигативные свойства растворов неэлектролитов
- •Давление насыщенного пара разбавленных растворов
- •Давление пара идеальных и реальных растворов
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Осмотическое давление разбавленных растворов
- •Коллигативные свойства растворов неэлектролитов
- •Давление насыщенного пара разбавленных растворов
- •Давление пара идеальных и реальных растворов
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Осмотическое давление разбавленных растворов
- •Теория электролитической диссоциации
- •Значение понятия
- •Изотонический коэффициент в растворах сильных электролитов
- •Электролиз растворов солей
- •Покрытие металлов слоем другого металла при помощи электролиза (гальваностегия).
- •Получение
- •Получение
- •[Править] Соединения хрома
- •Электрохимическая коррозия
- •[Править] Химическая коррозия
- •Электрохимическая коррозия
- •Методы защиты металлов от коррозии.
- •3.1 Катодная защита
- •3.2. Явление пассивности.
- •3.3 Анодная защита. Использование пассивности в практике защиты от коррозии.
- •3.4. Покрытия, как метод защиты металлов от коррозии.
- •3.5. Ингибиторы.
- •Физико-химические методы анализа
3.5. Ингибиторы.
Скорость коррозии можно снизить также изменением свойств коррозионной среды. Это достигается или соответствующей обработкой среды, в результате которой уменьшается ее агрессивность, или введением в коррозионную среду небольших добавок специальных веществ, так называемых замедлителей или ингибиторов коррозии.
Обработка среды включает в себя все способы, уменьшающие концентрацию ее компонентов, особенно опасных в коррозионном отношении. Так, например, в нейтральных солевых средах и пресной воде одним из самых агрессивных компонентов является кислород. Его удаляют деаэрацией (кипячение, дистилляция, барботаж инертного газа) или смазывают при помощи соответствующих реагентов (сульфиты, гидразин и т.п.). Уменьшение концентрации кислорода должно почти линейно снижать предельный ток его восстановления, а следовательно, и скорость коррозии металла. Агрессивность среды уменьшается также при ее подщелачивании, снижение общего содержания солей и замене более агрессивных ионов менее агрессивными. При противокоррозионной подготовке воды для уменьшения накипеобразования широко применяется ее очистка ионнообменными смолами.
Ингибиторы коррозии разделяют, в зависимости от условий их применения, на жидкофазные и парофазные или летучие. Жидкофазные ингибиторы делят в свою очередь на ингибиторы коррозии в нейтральных, щелочных и кислых средах. В качестве ингибиторов для нейтральных растворов чаще всего применяются неорганические вещества анионного типа. Их тормозящее действие связано, по-видимому, или с окислением поверхности металла (нитриты, хроматы), или с образованием пленки труднорастворимого соединения между металлом, данным анионом и, возможно, кислородом (фосфаты, гидрофосфаты). Исключение представляют в этом отношении соли бензойной кислоты, ингибирующий эффект которых связан, главным образом, с адсорбционными явлениями. Все ингибиторы для нейтральных сред тормозят преимущественно анодную реакцию, смещая стационарный потенциал в положительную сторону. До настоящего времени еще не удалось найти эффективных ингибиторов коррозии металлов в щелочных растворах. Некоторым тормозящим действием обладают лишь высокомолекулярные соединения.
В качестве ингибиторов кислотной коррозии применяются почти исключительно органические вещества, содержащие азот, серу или кислород в виде амино-, имино-, тиогрупп, а также в виде карбоксильных, карбонильных и некоторых других групп. Согласно наиболее распространенному мнению, действие ингибиторов кислотной коррозии связано с их адсорбцией на границе раздела металл – кислота. В результате адсорбции ингибиторов наблюдается торможение катодного и анодного процессов, снижающие скорость коррозии.
В
связи с преобладающим адсорбционным
эффектом органических ингибиторов
кислотной коррозии особое значение для
понимания механизма их действия и для
рационального подхода к созданию новых
ингибиторов приобретает величина заряда
поверхности корродирующего металла,
т.е. величина его >![]() >-
потенциала. Применение приведенной
шкалы потенциалов позволяет использовать
данные электрокапиллярных измерений
на ртути в растворах, содержащих
органические соединения, для оченки их
эффективности в качестве ингибиторов
при кислотной коррозии железа и других
металлов. Значение >
>-
потенциала корродирующего металла
позволяет не только предсказать, какие
вещества могут быть ингибиторами, но и
рассчитать коэффициенты торможения.
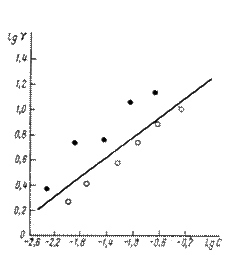
Экспериментальные значения коэффициентов
торможения кислотной коррозии железа
в присутствии различных количеств
диэтиламина, сопоставление с расчетной
прямой приведены на рис. 10. Расчетная
прямая вычерчена по уравнению
>-
потенциала. Применение приведенной
шкалы потенциалов позволяет использовать
данные электрокапиллярных измерений
на ртути в растворах, содержащих
органические соединения, для оченки их
эффективности в качестве ингибиторов
при кислотной коррозии железа и других
металлов. Значение >
>-
потенциала корродирующего металла
позволяет не только предсказать, какие
вещества могут быть ингибиторами, но и
рассчитать коэффициенты торможения.
Экспериментальные значения коэффициентов
торможения кислотной коррозии железа
в присутствии различных количеств
диэтиламина, сопоставление с расчетной
прямой приведены на рис. 10. Расчетная
прямая вычерчена по уравнению
![]() ,
,
где
![]() -
величина, постоянная для любого члена
гомологических рядов аминов и пиридинов,
а
-
величина, постоянная для любого члена
гомологических рядов аминов и пиридинов,
а
![]() найдены
из электрокапиллярных измерений по
ртути.
найдены
из электрокапиллярных измерений по
ртути.
 >
>
Рис. 9. Сопоставление опытных (-- и -- - данные двух авторов) и расчётных (прямая линия) коэффициентов торможения кислотной коррозии железа при введении разных количеств диэтиланилина.
Адсорбция, однако, является лишь необходимым условием проявления ингибирующего действия органических веществ, но не определяет полностью фактического эффекта ингибиторов. Последний зависит также от многих других факторов – электрохимических особенностей протекания данного коррозионного процесса, характера катодной реакции, величины и природы перенапряжения водорода (при коррозии с водородной деполяризацией), возможных химических превращений ингибитора в ходе коррозии и т.д.
Действие большинства ингибиторов кислотной коррозии усиливается при одновременном введении добавок поверхностно – активных анионов: галогенидов, сульфидов и роданидов.
Парофазные ингибиторы применяются для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере, при транспортировке и хранении. Парофазные ингибиторы вводятся в конвейеры, в упаковочные материалы или помещают в непосредственной близости от работающего агрегата. Благодаря достаточно высокой упругости паров, летучие ингибиторы достигают границы раздела металл – воздух и растворяются в пленке влаги, покрывающей металл. Далее они адсорбируются из раствора на поверхности металла. Тормозящие эффекты в этом случае подобны тем, какие наблюдаются при применение жидкофозных ингибиторов. В качестве парофазных ингибиторов используют обычно амины с небольшим молекулярным весом, в которые введены соответствующие группы, например NО2 или СО2 . В связи с особенностями использования парофазных ингибиторов к ним предъявляются повышенные требования в отношении их токсичности.
Ингибирование – сложный способ защиты, и его успешное применение в различных условиях требует широких познаний.
[1] От латинского corrodere-разъедать.
[2] Как известно F=U+TS, где F-изохорный термодинамический потенциал, или свободная энергия; U-внутренняя энергия; S-энтропия. В то же время G=H-TS, где H- энтальпия. По аналогии со свободной энергией, величина G часто называется свободной энтальпией. Особенно распространен этот термин в иностранной научной литературе.
Электрохимическая защита металлов основана на изменении потенциала защищаемого металла относится катодная защита анодная защита.
Рассмотрим коррозионный процесс повреждения металлических защитных покрытий.
1. Если металл покрыт менее активным металлом. Например, олово (Sn) хорошо покрывает железо (Fe) и достаточно стойко против действия разбавленных кислот. В случае повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову, то есть анод - железо (оно растворяется и разрушается), а катод - олово (остаётся без изменений).
2. Если металл покрытия более активный, чем защищаемый металл. Например, покрытия железа (Fe) цинком (Zn). При механическом повреждении цинкового покрытия возникает гальвангическая пара, в которой железо служит катодом (не растворяется), а цинк - анодом. В этом случае железо не будет разрушаться до тех пор, пока не разрушится весь цинк. что белее надёжное защитное покрытие то, что из металла более активного
Ингибиторы коррозии. замедлители окисления металла надо защитить металл от его разъедания кислотой.
органических ингибиторов применяют тиомочевинную сульфид-диамид углерода диэтиламид, уротропин нитриты иликаты
47-48
Полимеры и олигомеры
Вещества, состоящие из молекул больших размеров, большой молекулярной массы (порядка сотен, тысяч, миллионов и больше), называются высокомолекулярными соединениями. Полимеры - высокомолекулярные соединения, которые характеризуются молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров, называемые также макромолекулами, состоят из большого числа повторяющихся составных звеньев (группировок атомов). Вследствие большой молекулярной массы макромолекул полимеры приобретают некоторые специфические свойства. Они остаются практически неизменными при добавлении или удалении одного или нескольких составных звеньев.
Молекулы других веществ также могут включать определенное число составных звеньев, но при этом любое изменение числа таких звеньев приводит к изменению физических (иногда и химических) свойств вещества. Такие вещества выделены в отдельную группу химических соединений и называются олигомерами. Они занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями. Обычно число составных звеньев в молекулах олигомеров не превышает 100.Исходные вещества, используемые для получения полимеров и олигомеров и образующие одно или несколько звеньев, называются мономерами.
Индивидуальные свойства полимера определяются размером его макромолекулы и еë строением. Размер макромолекулы характеризуются числом повторения составных звеньев, называемых степенью полимеризации. Поэтому обобщëнная формула макромолекулы полимера записывается указанием составного звена (СЗ) в скобках и степени полимеризации n:
– [ –СЗ– ]n – .
Строение макромолекулы определяется составом и количеством атомов, входящих в составное звено, характером соединения звеньев между собой, пространственным расположением отдельных частей макромолекулы относительно других еë частей.
В соответствии с основным делением химических соединений, по типу входящих в составное звено элементов, можно выделить неорганические, органические и элементоорганические полимеры. По происхождению полимеры бывают природные (встречаются в природе, например, натуральный каучук, крахмал, целлюлоза, белки), модифицированные (дополнительно измененные природные полимеры, например, резина) и синтетические (полученные методом синтеза).
По характеру соединения составных звеньев в составе макромолекулы различают полимеры линейные, разветвленные, лестничные, трехмерные сшитые и их видоизменения. По отношению к нагреванию выделяют термопластичные и термореактивные. По типу химической реакции, используемой для получения, различают полимеризационные (реакция полимеризации) и поликонденсационные (реакция поликонденсации) полимеры.
Реакция полимеризации - процесс, в результате которого молекулы низкомолекулярного соединения (мономера) соединяются друг с другом при помощи перестройки ковалентных связей, образуя новое вещество (полимер), молекулярная масса которого в целое число раз, больше чем у мономера; полимеризация характерна, главным образом, для соединений с кратными (двойными или тройными) связями. Реакция поликонденсации - процесс образования полимера из низкомолекулярных соединений, содержащих две или несколько функциональных групп, сопровождающийся выделением за счëт этих групп таких веществ, как вода, аммиак, галогеноводород и т.п.; состав элементарного звена полимера в этом случае отличается от состава исходного мономера.
Органические полимеры. Это разнообразные материалы, обычно получаемые из доступного и дешевого сырья; на их основе получают пластические массы (пластмассы) - сложные композиции, в которые входят различные наполнители и добавки, придающие полимерам необходимый комплекс технических свойств, а также синтетические волокна.
К органическим полимерам относятся: полимеризационные смолы (полиэтилен, полипропилен, полистирол, поливинилхлорид, полиакрилаты, каучук), конденсационные смолы, фенолформальдегидные смолы, полиэфирные смолы (лавсан), полиамидные смолы (капрон, энант, анид).
Полимеризационные смолы - полимеры, получаемые реакцией полимеризации преимущественно этиленовых углеводородов или их производных.
Полиэтилен представляет собой полимер, образующийся при полимеризации этилена:
· · · + СН2 = СН2 + СН2 = СН2 + СН2 = СН2 + · · · → → · · · СН2 – СН2 – СН2 – СН2 – СН2 – · · · (полиэтилен)
или сокращенно:
n СН2 = СН2 |
→ |
( – СН2 – СН2 – )n |
этилен |
|
полиэтилен |
Реакцию полимеризации можно представить как результат раскрытия двойных связей в множестве молекул непредельного соединения (в данном случае этилена) и последующего соединения этих молекул друг с другом в одну гигантскую макромолекулу.
Элементоорганические полимеры. Перечень элементоорганических полимеров непрерывно увеличивается. Широкую известность приобрели кремнийорганические полимеры: органосилоксаны (часто их называют силиконами), органосилазаны. Эти полимеры включают неорганический скелет, состоящий из силиксановых (SiOSi) и силазановых (SiNSi) группировок, обрамленных органическими группами.
Впервые полиорганосилоксаны были синтезированы К. А. Андриановым. Им были получены производные ортокремниевой кислоты Si(OH)4, в которой одна,две или три гидроксильные группы заменены углеводородными радикалами. При гидролизе образованных эфиров должны были получаться соответствующие гидроксилсодержащие соединения кремния, но они тотчас же конденсируются с отщеплением молекул воды и образованием поликонденсатов.
При небольшой степени конденсации (если молекулы содержат около десяти атомов кремния) получаются жидкости, применяемые в качестве смазочных масел. К их ценным свойствам относятся незначительное изменение вязкости в широком интервале температур и химическая стойкость.
При более высокой степени конденсации получаются смолообразные вещества, которые весьма стойки к нагреванию; они обладают также хорошими электроизоляционными свойствами и применяются для изоляции электропроводов там, где обычная изоляция ввиду высокой температуры может быстро разрушаться. На основе кремнийорганических смол получают каучукоподобные материалы, сохраняющие свою эластичность при температурах от –60 до +200°С и не разрушающиеся даже при 300°С.
Физиологическая инертность полиорганосилоксанов позволяет использовать их в медицине
Политетрафторэтилен - полимер тетрафторэтилена
nCF2 = CF2 → (–CF2 – CF2–)n
Политетрафторэтилен выпускается в виде пластмассы, называемой тефлоном или фторопластом. Весьма стоек по отношению к щелочам, концентрированным кислотам и другим реагентам. По химической стойкости превосходит золото и платину. Негорюч, обладает высокими диэлектрическими свойствами. Применяется в химическом машиностроении, электротехнике.
Неорганические полимеры. Неорганических полимеров - множество. Отличительным и практически важным свойством многих неорганических полимеров является их термическая и химическая стойкость. Другой отличительной чертой многих неорганических полимеров является их твердость и хрупкость. Это обусловлено наличием пространственной кристаллической структуры и часто высокой долей ионной составляющей химической связи. Влияют и другие особенности природы химических связей углерода С - С и С - Н по отношению к химическим связям других элементов.
Простые вещества многих элементов имеют полимерную структуру. К ним относятся металлы и часть неметаллов. В полимерных соединениях атомы могут соединяться ковалентными связями с образованием пространственной решëтки (координационные структуры), сеток (слоистые структуры) или цепей (волокнистые структуры).
Для элементов главной подгруппы VI группы (S, Se, Te) характерно образование линейных полимерных цепей: пластическая модификация из цепочек · · · – S – S – S – · · · , свëрнутых в спирали, что согласуется с ковалентностью атомов этих элементов. Для элементов главных подгрупп III - V групп полимеры могут быть линейными, плоской структуры и пространственными, что также согласуется с ковалентностями атомов.
Углеродные полимеры: древесный и каменный уголь, кокс, графит, алмаз.
Углеродные стëкла имеют зеркальную поверхность и отличаются химической инертностью, непроницаемостью для газов и жидкостей, повышенной твëрдостью и устойчивостью к резким сскачкам температуры. Широкое распространение получили углеродные волокна.
К неорганическим полимерам относятся многие представители бинарных соединений: карбиды, нитриды, бориды и др.
Силикаты и алюмосиликаты. Самыми распространëнными сложными соединениями - неорганическими полимерами являются оксиды кремния, алюминия и других металлов. Основу земной коры составляют силикаты и алюмосиликаты, на долю которых приходится в базальтовых породах около 50 и 16% (масс.) соответственно.
К типичным представителям полимеров с координационной структурой относятся структуры алмаза и цинковой обманки. Обе структуры отличаются лишь тем, что в одной из них все позиции заняты атомами одного сорта, а в другой - атомами двух сортов. Для этих структур характерна тетраэдрическая координация всех атомов, что приводит к высокосимметричной и довольно плотной упаковке. По такому структурному типу кристаллизуются также карбид кремния, кремний, германий и серое олово. Трëхмерный каркас имеет также в различных модификациях диоксида кремния SiO2 -кварце, тридимите, кристобалите. Наличие трëхмерного каркаса в структуре соединения с ковалентными связями легко объясняет их важнейшие свойства: высокую твëрдость, очень высокие температуры плавления и кипения, нерастворимость как в неполярных, так и в полярных растворителях.
Во второй важнейшей модификации реализуется типичная слоистая структура. В каждом слое плоские шестиугольники из атомов углерода объединены в плоские сетки, напоминающие соты. Между слоями относительно большое расстояние и слабая связь. Поэтому слоистые минералы легко расщепляются на чешуйки. К ним относятся слюда и тальк. Со слоистой структурой некоторых силикатных минералов связано наличие у них ряда весьма ценных свойств. Так, способность глин к набуханию и их пластичность обусловлены тем, что между двойными слоями кремнекислородных колец могут внедрятся молекулы воды. В слюдах отдельные слои связываются через катионы. Способность катионов калия (К+) вытеснять из слюд другие катионы (Na+,Ca2+) приводит к накоплению калия, который может извлекаться растениями и использоваться при их росте, что немаловажно для сельского хозяйства.
Соединения с цепочечной или волокнистой структурой построены из длинных цепочек молекул, связанных между собой вандер-ваальсовыми силами. Появление сшивок между цепями придаëт полимерам новые свойства, в результате чего соответствующие минералы относятся к волокнистым. Эти соединения по своим свойствам в значительной степени приближаются к молекулярным веществам. К этой группе соединений относятся изополикислоты цепочечного строения и их анионы. Сходное строение имеют ют также асбестовидная модификация триоксида серы и шелковистые волокна сульфида кремния (неорганическое волокно).
Высокомолекулярные цепи содержатся в структурах многих органических природных и синтетических веществ, которые частот обладают весьма ценными свойствами (например, в целлюлозе, белках, каучуке, полиэтилене и перлоне).
Классификация
полимеров
Классификация
полимеров по составу основной цепи
макромолекул (наиболее распространенная):
I.
Карбоцепные ВМС – основные полимерные
цепи построены только из углеродных
атомов
II. Гетероцепные ВМС –
основные полимерные цепи, помимо атомов
углерода, содержат гетероатомы (кислород,
азот, фосфор, серу и т.д.)
III.
Элементоорганические полимерные
соединения – основные цепи макромолекул
содержат элементы, не входящие в состав
природных органических соединений (Si,
Al, Ti, B, Pb, Sb, Sn и др.)
Каждый класс
подразделяется на отдельные группы в
зависимости от строения цепи, наличия
связей, количества и природы заместителей,
боковых цепей. Гетероцепные соединения
классифицируются, кроме того, с учетом
природы и количества гетероатомов, а
элементоорганические полимеры – в
зависимости от сочетания углеводородных
звеньев с атомами кремния, титана,
алюминия и т.д.
I
а) полимеры
с насыщенными цепями: полипропилен –
[-CH2-CH-]n,
I
полиэтилен –
[-CH2-CH2-]n;
CH3
б) полимеры с ненасыщенными
цепями: полибутадиен – [-CH2-CH=CH-CH2-]n;
в)
галоген замещенные полимеры: тефлон –
[-CF2-CF2-]n, ПВХ – [-CH2-CHCl-]n;
OH
I
г) полимерные спирты: поливиниловый
спирт – [-CH2-CH-]n;
д) полимеры
производных спиртов: поливинилацетат
–
[-CH2-CH-]n;
I
OCOCH3
е) полимерные альдегиды и
кетоны: полиакролеин – [-СН2-СН-]n;
I
Н-С=О
ж)
полимеры карбоновых кислот: полиакриловая
кислота –
[-СН2-СН-]n;
I
СООН
з) полимерные нитрилы:
ПАН – [-СН2-СН-]n;
I
CN
и) полимеры ароматических
углеводородов: полистирол –
[-СН2-СН-]n.
![]() I
I
![]() II
Полимеры, содержащие в
основной цепи атомы кислорода:
а)
простые полиэфиры: полигликоли –
[-СН2-СН2-О-]n;
б) сложные полиэфиры:
полиэтиленгликольтерефталат –
[-О-СН2-СН2-О-С-С6Н4-С-]n;
II
II
O O
в) полимерные
перекиси: полимерная перекись стирола
–
[-СН2-СН-О-О-]n;
II
Полимеры, содержащие в
основной цепи атомы кислорода:
а)
простые полиэфиры: полигликоли –
[-СН2-СН2-О-]n;
б) сложные полиэфиры:
полиэтиленгликольтерефталат –
[-О-СН2-СН2-О-С-С6Н4-С-]n;
II
II
O O
в) полимерные
перекиси: полимерная перекись стирола
–
[-СН2-СН-О-О-]n;
![]() I
I
|
|
|
|
2. Полимеры, содержащие в основной цепи атомы азота:
а) полимерные амины: полиэтилендиамин – [-СН2–СН2–NН-]n;
б) полимерные амиды: поликапролактам – [-NН—(СH2)5—С-]n;
II капрон
O
3.Полимеры, содержащие в основной цепи одновременно атомы азота и кислорода – полиуретаны: [-С—NН—R—NН—С—О—R—О-]n;
II II
O О
4.Полимеры, содержащие в основной цепи атомы серы:
а) простые политиоэфиры [-(СН2)4– S-]n;
б) политетрасульфиды [-(СН2)4-S - S-]n;
II II
S S
5.Полимеры, содержащие в основной цепи атомы фосфора,
например : O
II
[- P – O-CH2-CH2-O-]n;
I
O-
III
1.Кремнийорганические полимерные соединения
а) полисилановые соединения R R
I I
[-Si-Si-]n;
I I
R R
б) полисилоксановые соединения
R R
I I
[-Si-O-Si-O-]n;
I I
R R
в) поликарбосилановые соединения
I I
[-Si-(-C-)n -Si-(-C-)n-]n;
I I
г) поликарбосилоксановые соединения
I I
[-O-Si-O-(-C-)n-]n;
I I
2. Титанорганические полимерные соединения, например:
OC4H9 OC4H9
I I
[-O – Ti – O – Ti-]n;
I I
OC4H9 OC4H9
3. Алюминийорганические полимерные соединения, например:
[-O – Al – O – Al-]n;
I I
OCOR OCOR
Классификация полимеров по структуре макромолекул
Макромолекулы могут иметь линейную, разветвленную и пространственную трехмерную структуру.
Линейные полимеры состоят из макромолекул линейной структуры; такие макромолекулы представляют собой совокупность мономерных звеньев (-А-) , соединённых в длинные неразветвлённые цепи:
nA ® (…-A - A-…)m + (…- A - A -…)R + …., где (…- А - А -…) - макромолекулы полимера с различным молекулярным весом.
Разветвлённые полимеры характеризуются наличием основных цепях макромолекул боковых ответвлений, более коротких, чем основная цепь, но также состоящих из повторяющихся мономерных звеньев:
A – A - …
Пространственные полимеры с трёхмерной структурой характеризуются наличием цепей макромолекул, связанных между собой силами основных валентностей при помощи поперечных мостиков, образованных атомами (-В-) или группами атомов, например мономерными звеньями (-А-)
-A – A – A – A – A – A – A –
A B
I I
-A – A – A – A – A – A –
B A
I I
- A – A – A – A – A – A -
Пространственными полимерами с частым расположением поперечных связей называют - сетчатые полимеры. Для трёхмерных полимеров понятие молекула теряет смысл, так как в них отдельные молекулы соединены между собой во всех направлениях, образуя огромные макромолекулы.
Классификация по поведению при нагревании
термопластичные - полимеры линейной или разветвлённой структуры, свойства которых обратимы при многократном нагревании и охлаждении;
термореактивные - некоторые линейные и разветвлённые полимеры, макромолекулы которых при нагревании в результате происходящих между ними химических взаимодействий соединяются друг с другом; при этом образуются пространственные сетчатые структуры за счёт прочных химических связей. После прогрева, термореактивные полимеры обычно становятся неплавкими и нерастворимыми – происходит процесс их необратимого отверждения.
Классификация по горючести
Эта классификация весьма приближенная, так как воспламенение и горение материалов зависят не только от природы материала, но и от температуры источника зажигания, условий воспламенения, формы изделия или конструкций и т.д.
Согласно этой классификации полимерные материалы делят на горючие, трудногорючие и негорючие. Из сгораемых материалов выделяют трудновоспламеняемые, а из них и трудносгораемые - самозатухающие.
Примеры сгораемых полимеров: полиэтилен, полистирол, полиметилметакрилат, поливинилацетат, эпоксидные смолы, целлюлоза и т.д.
Примеры трудносгораемых полимеров: ПВХ, тефлон, фенолформальдегидные смолы, мочевиноформальдегидные смолы.
Классификация по способу получения (происхождения)
- природные (белки, нуклеиновые кислоты, природные смолы) (животного и
растительного происхождения);
- синтетические (полиэтилен, полипропилен и т. д.);
- искусственные (химическая модификация природных полимеров – эфиры
целлюлозы).
Органические и неорганические полимеры
Неорганические: кварц, силикаты, алмаз, графит, корунд, карбин, карбид бора и т. д.
Органические: каучуки, целлюлоза, крахмал, органическое стекло и
т. д.
Физико-химические свойства полимеров
1. Степень полимеризации – величина средняя (смесь молекул).
2. Труднорастворимы (растворимость падает с увеличением молекулярной
массы).
3. Нелетучесть.
4. Нет точной Тпл. (усредненная).
5. Полимеры, содержащие в своём составе галогены, устойчивы к кислотам и
щелочам (тефлон, ПВХ).
Полимеры, содержащие CN-группы, устойчивы к действию света, масла,
бензинов (нитрон).
Смачиваемость зависит от наличия гидрофильных групп (-NH-, -COOH,
-ОН …).
8. Существует только два агрегатных соединения – твёрдое и жидкое.
9. Вязкость полимерных материалов очень большая.
10. Отдельные звенья макромолекул могут самостоятельно вступать
в химические реакции, т.е. вести себя как самостоятельные единицы.
11. Свойства полимера зависят от геометрической формы макромолекул.
12. Появление водородных связей между макромолекулами значительно
повышает прочность полимера:
I I
I I
HN (CH2)5
I I
 (CH2)5 O=C
(CH2)5 O=C
I I
…O=C NH…
I I
NH (CH2)5
I I
(CH2)5 C=O
I I
I I
13. Кратные связи обусловливают жёсткость и высокую термическую
стойкость, (-CH=CH-)4 - полиены устойчивы до 800 оС, -CºC- полиины
(карбин —СºС— ) - до 2300 оC.
Основные реакции термического разложения и горения полимеров
Виды деструкции:
химическая (+Н2О, + кислоты, + щёлочи и т. д.);
механическая (необратимая деформация под действием нагрузки);
окислительная (О2 + нагрев);
термическая;
фотохимическая (hn);
радиационные (n, a, b, g- излучения);
биологическая (нитраты целлюлозы, ряд каучуков разлагаются под действием микроорганизмов).
При разложении полимеров образуется твердый (коксовый остаток), жидкие и газообразные вещества. Жидкие и газообразные вещества называются, "летучими". Выделение "летучих" веществ – признак разложения полимеров.
Температура, при которой начинают выделяться "летучие" вещества - температура начала разложения.
Конечными продуктами разложения сложного вещества (полимеров) является простые вещества (C2H2 – C, H2 , капрон – C, H2, O2, N2). Распад на простые вещества возможен при Т - 3000 оС.
На пожаре Т » 1500 оС и состав выделяющихся веществ сложный - (H2, CO, C2H4, C2H6, СН4, СО2, НСN, NН3 и т.д.)
Молекулы с более высокой молекулярной массой составляют сложные вещества. Таким образом, при воздействии сравнительно низких температур (до 500-600 оС) на полимер, летучие вещества в своём составе будут содержать больше смолистых и меньше газообразных веществ. С повышением температуры образование газообразных веществ увеличивается.
В зависимости от того, разложение полимеров идёт в присутствии или отсутствии О2 воздуха, различают термическое и термоокислительное разложение.
Под термическим разложением понимают распад полимерного материала под действием температуры в отсутствии окислителя (относительное движение составляющих приводит к разрушению связей). Термическая деструкция обычно идёт по радикальному механизму. При этом происходит деполимеризация, т.е. отщепление мономеров.
При 300 оС полистирол деполимеризуется на 60-70%, органическое стекло – на 90-95 % :
CH3 CH3 CH3 CH3 CH3 CH3
I I I I · I I
—CH2 – C—CH2—C—CH=C ¾® –CH2—C—CH2 + ×C—CH==C
I I I I I I
COOCH3 COOCH3 COOCH3 COOCH3 COOCH3 COOCH3
Термоокислительная деструкция – процесс разрушения макромолекул под действием высоких температур в присутствии кислорода. Этот процесс может идти при более низких температурах, чем термическая деструкция.
Первичные продукты – перекиси, при распаде которых образуются свободные радикалы.
-CH=CH- + O2 ¾® -CH-CH- ¾® -CH-CH- ¾® -CH + CH-
I I I I II II
O – O ×O ×O O O
OOH O×
O2 I I
-CH2-CH- ¾® -CH2-C- ¾® -CH2-C- + ×ОН
O× O
I II
-CH2-C-CH2-CH- ® -CH2-C + ×CH2-CH-
Образуется вода, альдегиды, кетоны, спирты и т.д.
R× + -CH2-CH-CH2-CH- ¾® RH + -CH2-C·-CH2-CH- + O2 ¾®
I I I I
Cl Cl Cl Cl
O-O× O-OH
I I
® -CH2-C-CH2-CH- + RH ¾® -CH2-C-CH2-CH- + R× ¾®
I I I I
Cl Cl Cl Cl
O× O
I II
® -CH2-C-CH2-CH- + OH× ¾® -CH2-C + -CH2-CH-
I I I I
Cl Cl Cl Cl
Особенности горения полимеров
Для сгорания единицы веса полимера требуются большие объёмы воздуха (в 1.5 – 2 раза больше, чем для древесины - 4.5 м3/кг);
Образуются большие объемы продуктов горения;
Значительный недожог – образуется дым;
Содержится много токсичных продуктов недожога (CO, NO2, HCl, HCN, C и т.д.);
Плавление и растекание – распространение пожара;
Высокая температура горения – 1100 – 1300 оC;
Высокая излучательная способность у пламени.
Состав продуктов разложения и горения полимеров
Древесина состоит из целлюлозы (52 – 59 %), лигнина (21 – 28 %), гемицеллюлозы, смолы, терпены и т.д.
Лигнин обуславливает одеревенение растительных тканей, заполняет пространство древесными клетками, где накапливается до 70 %. Аморфная масса желто-коричневого цвета. Нерастворим в крепкой H2SO4. Молекулярный вес 10 тысяч и выше.
Гемицеллюлоза – ряд сложных полисахаридов, служащих материалов для стенок клеток и запасными веществами для получения сахара. Неоднородна. Нерастворима в воде, не обладает восстановительными свойствами.
Целлюлоза – углевод, из которого строится состав растений (клетчатка). При полном гидролизе она целиком распадается на глюкозу. Её очень много в хлопке, льне. Минеральные кислоты ее осахаривают:

 H H
H
H H
HCH2OH H OH
® ….. (C6H10O5)n + 3ОН- ….
В древесине 49,5% С, 6,3% Н, 44,2% О.
До 110 оС удаляется влага, 150-200 оС – продукты разложения состоят в основном из СО2 и Н2О. При температуре свыше 200 оС образуются газообразные горючие вещества: СО, углеводороды, Н2 и т.д.
В лабораторных условиях в первую очередь разлагается гемицеллюлоза – 220-250 оС, затем целлюлоза – 280-350 оС, затем лигнин – 280-500 оС.
Максимальный выход летучих веществ наблюдается при 270-450 оС (до 80 %).
При 400-500 оС – в остатке почти нет летучих веществ – тление. В состав смолистых веществ входят вода, фенолы, этиленгликоль, углеводороды, спирты, кислоты, воск, и т.д.
Оргстекло
Деполимеризация: при 300 оС – на 90-95 %.
I I
-C-CH2- ® C=CH2
I I
Могут образовываться и другие продукты при термоокислительной деструкции. При пламенном горении в основном образуется СО2 и Н2О.
Полистирол
До 400 оС деполимеризация
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При пожаре - пеплообразование, растекание, чёрный дым.
ПВХ материалы
Распад начинается уже при температуре 160-180 оС. Образуется HCI (до 95 % хлора переходит в него).
Хлоропреновый каучук и резина
Повышенная термическая устойчивость (такое строение, наличие галогена). Выделение НСI начинается при 200-250 оС и заканчивается при 400 оС.
Тефлон
Устойчив термически до 400 оС. Способен к горению только в среде, обогащенной кислородом. В условиях пожара разлагается до мономера С2F4.
Капрон, нитрон, шерсть
Продукты горения: СО, СО2, Н2О, СnН2n+2, HCN, NO, NO2, NH3 и другие (для шерсти – SO2, H2S, S – в виде жёлтого дыма). Комбинированное действие
49
50
