
- •Билет 1
- •Билет 2
- •Билет 3
- •Билет 4
- •1. Зависимость скорости реакции от температуры
- •Билет 5
- •Билет 6
- •Билет 7
- •Билет 8 и 9
- •Билет 11
- •Билет 12
- •Билет 12
- •Билет 15
- •Билет 16
- •Билет 17
- •Билет 18
- •Билет 19
- •Билет 20
- •Билет 21
- •Билет 22
- •Билет 23
- •Билет 24
- •Билет 25
- •Билет 27
- •Билет 28
- •Билет 29
- •Билет 31
- •Билет 33
- •Билет 35
- •Билет 36
- •Билет 38
- •Билет 39
- •Билет 40
- •Билет 41
- •Билет 42 методы защиты от коррозии металлов и сплавов
- •Билет 43
- •Билет 50
- •Практика
Билет 19
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Классификация кислот
По содержанию кислорода
бескислородные (HCl, H2S);
кислородосодержащие (HNO3,H2SO4).
По основности — количество кислых атомов водорода
Одноосновные (HNO3);
Двухосновные (H2SeO4, двухосновные предельные карбоновые кислоты);
Трёхосновные (H3PO4, H3BO3).
Полиосновные (практически не встречаются).
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1×10−3 (HNO3);
Слабые — константа диссоциации меньше 1×10−3 (уксусная кислота Kд= 1,7×10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH,CH3COOH);
По летучести
Летучие (H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
Химические свойства кислот
Взаимодействие с основными оксидами с образованием соли и воды:
![]()
Взаимодействие с амфотерными оксидами с образованием соли и воды:
![]()
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
![]()
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
![]()
Взаимодействие с солями, если выпадает осадок или выделяется газ:
![]()
Сильные кислоты вытесняют более слабые из их солей:
![]()
![]()
(в
данном случае образуется непрочная угольная
кислота ![]() ,
которая сразу же распадается
на воду и углекислый
газ)
,
которая сразу же распадается
на воду и углекислый
газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты
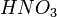 любой
концентрации и концентрированной серной
кислоты
любой
концентрации и концентрированной серной
кислоты 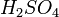 ),
если образующаяся соль растворима:
),
если образующаяся соль растворима:
![]()
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
![]()
См. статью Взаимодействие кислот с металлами.
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
![]()
Например,
![]()
Основа́ния — класс химических соединений.
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
Основания классифицируются по ряду признаков.
По растворимости в воде.
Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид кальция Ca(OH)2, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
Практически нерастворимые основания: Mg(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
По количеству гидроксильных групп в молекуле.
Однокислотные (гидроксид натрия NaOH)
Двукислотные (гидроксид меди(II) Cu(OH)2)
Трехкислотные (гидроксид железа(III) Fe(OH)3)
По летучести.
Летучие: NH3, CH3-NH2
Нелетучие: щёлочи, нерастворимые основания.
По стабильности.
Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2
Нестабильные: гидроксид аммония NH3·H2O (гидрат аммиака).
По степени электролитической диссоциации.
Сильные (α > 30 %): щёлочи.
Слабые (α < 3 %): нерастворимые основания.
По наличию кислорода.
Кислородсодержащие: гидроксид калия KOH, гидроксид стронция Sr(OH)2
Бескислородные: аммиак NH3, амины.
Со́ли —
класс химических соединений, к которому
относятся вещества,
состоящие из катионов металла (или
катионов аммония ![]() ;
известны соли фосфония
;
известны соли фосфония ![]() или гидроксония
или гидроксония ![]() )
и анионов кислотного
остатка.
)
и анионов кислотного
остатка.
Типы солей
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример:
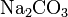 ,
, 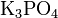 .
.Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример:
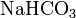 ,
, 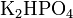 .
.Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример:
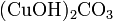 .
.Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример:
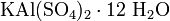 .
.Смешанные соли — в их составе присутствует два различных аниона. Пример:
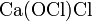 .
.Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример:
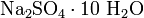 .
.Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример:
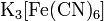 ,
, 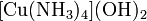 .
.
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостейили по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C.
