
- •Билет 1
- •Билет 2
- •Билет 3
- •Билет 4
- •1. Зависимость скорости реакции от температуры
- •Билет 5
- •Билет 6
- •Билет 7
- •Билет 8 и 9
- •Билет 11
- •Билет 12
- •Билет 12
- •Билет 15
- •Билет 16
- •Билет 17
- •Билет 18
- •Билет 19
- •Билет 20
- •Билет 21
- •Билет 22
- •Билет 23
- •Билет 24
- •Билет 25
- •Билет 27
- •Билет 28
- •Билет 29
- •Билет 31
- •Билет 33
- •Билет 35
- •Билет 36
- •Билет 38
- •Билет 39
- •Билет 40
- •Билет 41
- •Билет 42 методы защиты от коррозии металлов и сплавов
- •Билет 43
- •Билет 50
- •Практика
Билет 33
Водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП). Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе.
Билет 35
Концентрационный элемент – это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями (концентрациями) а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
НEРНСТА УРАВНЕНИЕ, описывает зависимость равновесного потенциала электрода от термодинамич. активности (концентрации) потенциал-определяющих компонентов р-ра электролита
Вывод уравнения Нернста
![]() ,
,
где
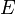 —
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;
—
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах; — универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
— универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);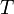 —
абсолютная
температура;
—
абсолютная
температура;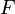 — число
Фарадея,
равное 96485,35 Кл/моль;
— число
Фарадея,
равное 96485,35 Кл/моль;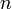 —
число моль электронов,
участвующих в процессе;
—
число моль электронов,
участвующих в процессе;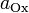 и
и 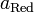 — активности соответственно окисленной и восстановленной форм
вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм
вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
![]()
