
- •Билет 1
- •Билет 2
- •Билет 3
- •Билет 4
- •1. Зависимость скорости реакции от температуры
- •Билет 5
- •Билет 6
- •Билет 7
- •Билет 8 и 9
- •Билет 11
- •Билет 12
- •Билет 12
- •Билет 15
- •Билет 16
- •Билет 17
- •Билет 18
- •Билет 19
- •Билет 20
- •Билет 21
- •Билет 22
- •Билет 23
- •Билет 24
- •Билет 25
- •Билет 27
- •Билет 28
- •Билет 29
- •Билет 31
- •Билет 33
- •Билет 35
- •Билет 36
- •Билет 38
- •Билет 39
- •Билет 40
- •Билет 41
- •Билет 42 методы защиты от коррозии металлов и сплавов
- •Билет 43
- •Билет 50
- •Практика
Практика
1.
1. Определите, как изменится скорость реакции, если концентрация исходных веществ увеличится в N раз.
изменение концентрации: увеличение концентрации исходных веществ приводит к увеличению скорости прямой реакции, при этом протекающий в системе процесс завершится, когда скорости прямой и обратной реакций станут равны и установится новое равновесие. Уменьшение концентрации одного из продуктов реакции (вывод из системы) приводит к смещению равновесия в сторону его образования.
CO2+2NH3-->(NH2)2CO+H2O
v1= k*c(CO2)*c^2(NH3)
v2 = k*2c(CO2)*2c(NH3)*2c(NH3) = k*2c(CO2)*4c^2(NH3)
v2/v1 = (k*2c(CO2)*4c^2(NH3)) / (k*c(CO2)*c^2(NH3))
v2/v1 = 8
Cкорость реакции увеличится в 8 раз при увеличении концентрации исходных веществ в два раза.
увеличится в N4 раз.
2.
2. Напишите математическое выражение для скорости реакции.
скорость реакции А+В=С вычисляется по формуле:
v1= k1CACB,
скорость реакции А+2В=D вычисляется по формуле:
v2= k2CACB.
CA и CB – концентрации веществ А и В (моль/л),
k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакции.
Константа скорости зависит только от температуры, но не от концентрации веществ.
Эти формулы также называют кинетическими уравнениями.
3.
5. Сформулируйте условия для смещения равновесия в сторону исходных веществ для реакции.
Повысить давление в Паскалях, понизить давление в атмосферах, повысить процентную и понизить (одновременно!) молярную концентрацию, а так же нормализовать градиент температур.
4.
Константа химического равновесия
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации Сi, парциальные давления Pi или мольные доли Xi реагирующих веществ. Для некоторой реакции
![]()
соответствующие константы равновесия выражаются следующим образом:
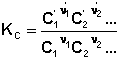 (1)
(1) 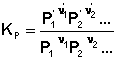 (2)
(2)
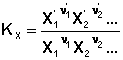 (3)
(3)
5.
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры, кипения раствора (Δt) no сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением:
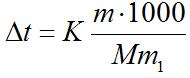 (1)
(1)
где К – криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; m и М – соответственно масса растворенного вещества и его мольная масса; m1 – масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим из формулы (1):
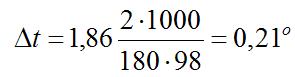
Вода кристаллизуется при 0°С, следовательно, температуры кристаллизации раствора 0 – 0,21 = -0,21°С.
Из формулы (1) находим и повышение температуры кипения 2%-ного раствора:
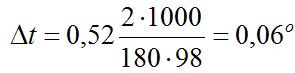
Вода кипит при 100°С, следовательно, температура кипения этого растворе 100 + 0,06 = 100,06°С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты C6H5COOH в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С, Вычислите эбуллиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения Δt = 46,529 – 46,3 = 0,229°. Мольная масса бензойной кислоты 122 г/моль. Из формулы (1) находим эбуллиоскопическую константу:
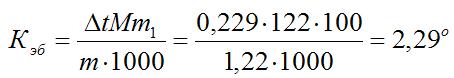
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислить мольную массу глицерина.
Решение. Температура кристаллизации чистой воды 0°С, следовательно, понижение температуры кристаллизации Δt = 0 – (-0,279) = 0,279°. Масса глицерина т(г), приходящаяся на 1000 г воды,
![]()
Подставляя в уравнение
![]() (2)
(2)
данные, вычисляем мольную массу глицерина:
![]()
Пример 4. Вычислите процентную концентрацию водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,465°С.
Решение. Температура кристаллизации чистой воды 0°С, следовательно, Δt = 0 – (-0,465) = 0,465°. Мольная масса мочевины 60 г/моль. Находим массу m(г) растворенного вещества, приходящуюся на 100 г воды, из формулы (2):
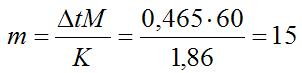
Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения:
в 1015 г раствора – 15 г вещества.
100 - х
х = 1,48%.
6.
ОВР

7.
3)Составить схему гальванического элемента , состоящего из двух кобальтовых электродов. Рассчитать ЭДС данного элемента?
Схема концентрационного кобальтого гальванического элемента: А(-) Co|Co2+ (0,01 M) || Co2+ (1 M)|Co (+)K Схема электродных процессов: А(-) Co0 - 2e ---> Co2+ |1| - окисление К(+) Co2+ + 2e ---> Co0 |1| - восстановление Определим потенциал кобольтового анода по уравнению Нернста: E(анод) = E0(Co2+/Со) + (0,059/2)*lg[Co2+] = -0,28 + (0,059/2)*lg(0,01) = -0,37 B Катод находится в стандартных условиях, поэтому E(катод) = E0(Co2+/Со) = -0,28 В ЭДС гальванического элемента: ЭДС = E(катод) - E(анод) = -0,28 - (-0,37) = 0,09 В
