
- •Министерство образования и науки российской федерации пензенский государственный педагогический университет имени в. Г. Белинского
- •Рабочая программа дисциплины Химия
- •1. Цели освоения дисциплины
- •2. Место дисциплины в структуре ооп бакалавриата
- •3. Компетенции обучающегося, формируемые в результате освоения дисциплины «Химия»
- •4. Структура и содержание дисциплины «Химия»
- •4.1. Структура дисциплины
- •4.2. Содержание дисциплины Часть I. Общая химия
- •1. Введение
- •2. Основные химические понятия и теоретические представления в химии
- •3. Классификация и номенклатура неорганических соединений
- •4. Электронное строение атома
- •5. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •6. Химическая связь
- •7. Энергетика химических процессов Химическая термодинамика в приложении к биологическим системам
- •8. Скорость химических реакций (Кинетика и механизмы химических реакций)
- •9. Химическое равновесие
- •10. Вода
- •11. Коллоидно-дисперсные системы
- •12. Растворы
- •13. Растворы электролитов
- •14. Координационные (комплексные) соединения
- •15. Окислительно-восстановительные процессы
- •16. Химия биогенных элементов
- •5. Образовательные технологии
- •Литература для самостоятельной работы на 1 семестр
- •Методические указания к самостоятельной работе студентов
- •Выполнение и защита мини-проектов (с компьютерной презентацией).
- •6.2. Материалы для проведения текущего, промежуточного и итогового контроля знаний
- •1 Семестр Образец варианта Контрольной работы №1 Вариант 1
- •Вариант 2
- •Вариант 3
- •Образец варианта Контрольной работы № 2 Вариант 1
- •Вариант 2
- •Вариант 3.
- •Образец варианта Контрольной работы № 3 Вариант 1
- •Вариант 2
- •Вариант 3
- •Образец варианта Контрольного теста №1 (итоговый) Основы общей и физической химии
- •Вопросы к Коллоквиуму № 1 Химическая кинетика и равновесие
- •Контрольные вопросы и упражнения:
- •Вопросы к Коллоквиуму № 2 Растворы
- •Контрольные вопросы и упражнения:
- •Вопросы к Коллоквиуму № 3 Окислительно-восстановительные реакции
- •Контрольные вопросы и упражнения:
- •Вопросы к Коллоквиуму № 4 Комплексные соединения
- •Контрольные вопросы и упражнения:
- •Часть 1. Общая химия
- •7. Учебно-методическое и информационное обеспечение
- •Дисциплины «Химия»
- •По общей химии
- •Основная
- •Дополнительная
- •В) программное обеспечение и Интернет-ресурсы
- •8. Материально-техническое обеспечение дисциплины «Химия»
Вопросы к Коллоквиуму № 1 Химическая кинетика и равновесие
-
Гомогенные и гетерогенные реакции. Скорость химической реакции и факторы, от которых она зависит. Закон действующих масс. Константа скорости. Зависимость скорости реакции от температуры. Понятие об энергетическом барьере, активных молекулах и активации.
-
Цепные реакции - неразветвленные и разветвленные.
-
Катализ гомогенный и гетерогенный. Теория образования промежуточных соединений в катализе.
-
Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия. Принцип Ле-Шателье.
Контрольные вопросы и упражнения:
-
Написать формулу для расчета констант скорости следующих реакций:
4NH4+3O2→ 2H2+6H2O(пар)
NO+O2 → 2NO2
C+H2O(пар) → CO+H2
-
Как изменятся скорость прямой и обратной реакции N2+3H2
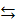 2NH3,
если при неизменной температуре давление
на смесь газов увеличить втрое?
2NH3,
если при неизменной температуре давление
на смесь газов увеличить втрое? -
Как изменится скорость прямой реакции CO+Cl2
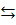 COCl2
при увеличении: а) концентрации СО2
в два раза; б) концентрации хлора в два
раза; в) концентрации обоих веществ в
два раза?
COCl2
при увеличении: а) концентрации СО2
в два раза; б) концентрации хлора в два
раза; в) концентрации обоих веществ в
два раза? -
На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 50 раз ( γ = 3 )?
-
Приведите примеры неразветвленной и разветвленной цепной реакции.
-
Приведите примеры обратимых и необратимых реакций.
-
Напишите уравнение константы химического равновесия для следующих реакций:
N2+O2![]() 2NO
2NO
CO+H2O![]() CO2+H2
CO2+H2
N2+3H2![]() 3
3
CO2+C![]() 2CO
2CO
-
В каком направлении будет смещаться химическое равновесие при изменении температуры и давления в следующих реакциях:
3O2![]() 2O3-299кдж
2O3-299кдж
N2+O2![]() 2NO-163кдж
2NO-163кдж
2CO+O2![]() 2CO2+565кдж
2CO2+565кдж
C+H2O
(пар)
![]() CO+H2-130кдж
CO+H2-130кдж
-
Как следует изменить температуру и давление системы 4HCl+O2
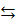 2H2O+2Cl2+
+112 кДж, чтобы повысить выход хлора?
2H2O+2Cl2+
+112 кДж, чтобы повысить выход хлора?
Вопросы к Коллоквиуму № 2 Растворы
-
Классификация дисперсных систем по степени дисперсности и агрегатному состоянию дисперсной фазы и дисперсной среды. Общая характеристика растворов. Тепловые эффекты растворения и гидратации. Ненасыщенные, насыщенные и перенасыщенные растворы. Растворимость твердых, жидких и газообразных веществ в жидкостях. Закон Генри- Дальтона. Способы выражения концентрации растворов. Титрование. Гидратная теория растворов Д. И. Менделеева и теория разбавленных растворов Вант - Гоффа.
-
Растворы неэлектролитов. Осмос. Осмотическое давление. Пониженное давление насыщенного пара растворов. Температура кипения и замерзания растворов. Законы Рауля.
-
Отклонение растворов электролитов от законов Вант - Гоффа и Рауля. Изотонический коэффициент i и его физический смысл. Теория электролитической диссоциации Аррениуса. Классическая и протолитическая теория кислот и оснований. Степень диссоциации электролитов и факторы, влияющие на степень диссоциации. Константа диссоциации. Закон разбавления Оствальда и пределы его применимости.
-
Сильные и слабые электролиты. Кажущаяся степень диссоциации сильных электролитов. Понятие об активности.
-
Влияние одноименного иона на диссоциацию слабого электролита. Условия смещения ионных равновесий. Произведение растворимости.
-
Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель рН. Понятие об индикаторах. Гидролиз солей. Типичные случаи гидролиза солей.
