
- •Определение и классификация
- •Общая формула оксидов: ЭmOn , где
- •Оксиды классифицируют на:
- •Солеобразующие оксиды
- •Безразличные (индифферентные) несолеобразующие оксиды
- •Номенклатура
- •Графические формулы оксидов
- •Свойства оксидов
- •Основные оксиды
- •Химические свойства основных оксидов:
- •Взаимодействие с водой
- •Взаимодействие с кислотными оксидами
- •3. Взаимодействие с кислотами
- •8. Большинство оксидов термостойки. Разлагаются только оксиды благородных металлов и ртути
- •9. При высоких температурах со восстанавливает многие металлы из их оксидов
- •10. Основные оксиды с основаниями не реагируют
- •Кислотные оксиды Физические свойства кислотных оксидов:
- •Химические свойства кислотных оксидов:
- •1.Взаимодействие с водой
- •2. Взаимодействие с основными оксидами
- •3.Взаимодействие с основаниями
- •4. Кислотные оксиды взаимодействуют с неметаллами
- •5. Большинство оксидов термостойки. Некоторые оксиды разлагаются с выделением кислорода. В результате реакций степень окисления уменьшается
- •6. Оксиды с солями реагируют редко и только при сплавлении
- •7 . Кислотные оксиды с кислотами не реагируют
- •Амфотерные оксиды Физические свойства амфотерных оксидов:
- •Химические свойства амфотерных оксидов:
- •Получение оксидов
- •Определение и классификация
- •Кислоты классифицируют по:
- •По содержанию кислорода:
- •1. Взаимодействие активных металлов с водой
- •2. Непосредственное соединение основных оксидов с водой
- •3. Электролиз водных растворов солей щелочных и щелочноземельных металлов
- •4. Взаимодействие гидроксидов кальция и бария с растворами солей щелочных металлов (соответственно, карбонатами и сульфатами):
- •5. Взаимодействие солей со щелочами
- •Амфотерные гидроксиды получают взаимодействием соли со щелочью без избытка
- •Амфотерные гидроксиды выделяются также в процессе разрушения гидрокомплексов при действии кислот:
- •1. Основные свойства
- •Кислотные свойства
- •Термическое разложение
- •Общая формула солей: МеnАm, где
- •Кислые соли
- •Основные соли
- •Двойные соли
- •Комплексные соли
- •Строение:
- •Смешанные соли
- •Номенклатура Номенклатура средних солей
- •Номенклатура кислых солей
- •Номенклатура основных солей
- •Номенклатура комплексных солей
- •Графические формулы солей
- •Химические свойства солей Химические свойства средних солей
- •Химические свойства кислых солей
- •Получение кислых солей
- •Получение основных солей
- •Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
- •Получение комплексных солей
- •Получение двойных солей
Номенклатура кислых солей
Номенклатура кислых солей отличается от номенклатуры средних солей только добавлением приставки «гидро…» или «дигидро…» к названию соли:
|
NaHCO3 гидрокарбонат натрия |
|
Са(Н2РО4)2 дигидрофосфат кальция |
Номенклатура основных солей
Чаще всего выводятся из названий средних, применяя приставку гидрокси-. Если гидроксильных групп в молекуле основной соли больше одной, то количество их указывают приставками ди-, три-, тетра- и т. д.:
|
Аl(OH)Cl2 гидроксихлорид алюминия |
|
Сr(OH)2NO3 дигидроксинитрат хрома |
|
Тi(OH)3CI тригидроксихлорид титана |
Номенклатура комплексных солей
Сначала называют анионы в именительном падеже, а затем катион в родительном падеже.
Если в комплексное соединение входит комплексный катион, то сначала называют лиганды – нейтральные молекулы, а затем – лиганды – ионы. При этом аммиак называют аммин (его называют первым), воду – аква (называют после аммиака); число лигандов указывают греческими числительными:
ди – 2,
три – 3,
тетра – 4,
пента – 5,
гекса – 6.
К
латинскому названию лигандов добавляют
окончание «о». Например, F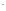 -
фторо,
Br
-
фторо,
Br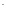 -
бромо,
Cl
-
бромо,
Cl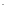 -
хлоро,
I
-
хлоро,
I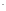 -
иодо,
NO
-
иодо,
NO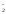 - нитро,
NO
- нитро,
NO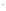 - нитрозо,
S2O
- нитрозо,
S2O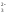 - тиосульфато,
C2O
- тиосульфато,
C2O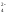 - оксалато,
CN
- оксалато,
CN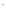 -
циано,
SCN
-
циано,
SCN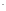 - родано,
OH
- родано,
OH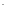 - гидроксо,
H
- гидроксо,
H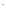 - гидридо,
O
- гидридо,
O - оксо,
S2-
- тио.
Затем называют комплексообразователь
(русское название элемента в родительном
падеже). В скобках показывают его степень
окисления.
- оксо,
S2-
- тио.
Затем называют комплексообразователь
(русское название элемента в родительном
падеже). В скобках показывают его степень
окисления.
Например:
|
[Ag(NH3)2]Cl хлорид диаммин – серебра (I) |
|
[Cu(NH3)4]SO4 сульфат тетрааммин – меди (II) |
|
[PtCl(NH3)5]Cl хлорид пентааммин–хлороплатины (IV) |
Если в комплексное соединение входит комплексный анион, то лиганды называют в том же порядке. После этого называют комплексообразователь, используя латинское название элемента с добавлением окончания «ат», а перед названием элемента в скобках указывают степень его окисления. Затем называют катион внешней сферы в родительном падеже.
Например:
|
K[Ag(CN)2] дициано – (I) аргентат калия |
|
K4[Fe(CN)6] гексациано – (II) феррат калия |
|
NH4[Cr(SCN)4(NH3)2] диаммин – (III) хромат аммония |
Название нейтральных комплексов составляют из названий лигандов (в указанном порядке) и русских названий центрального атома в именительном падеже. При этом указание степени окисления опускают.
Например:
|
PtCl4 (NH3)2] диаммин-тетрахлоро-платина |
|
[Co(NO2)3(NH3)3] триаммин-тринитро-кобальт |
Графические формулы солей
Для того, чтобы изобразить формулу соли графически, следует :
-
Правильно написать эмпирическую формулу этого соединения.
-
Учитывая, что любая соль может быть представлена, как продукт нейтрализации соответствующих кислот и оснований, следует написать уравнение реакции и определить какое количество молекул кислоты и основания требуется для получения данной соли.
-
Построить графические формулы установленного числа молекул основания и кислоты и, « мысленно» убрав образующие воду гидроксо-анионы и катионы водорода кислоты, получить графическую формулы соли.
Примеры :
|
Сульфат калия . |
|
|
|
2KOH + H2SO4 = K2SO4 +2H2O |
|
Примеры графических формул солей:
Na2SO4 ( средняя соль)
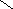
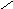
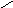 Na
–
O O
Na
–
O O
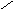
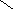
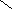 S
S
Na – O O
- сульфат натрия
NaHCO3( кислая соль)
 H
– O
H
– O
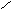 C
= O
-
гидрокарбонат
натрия
C
= O
-
гидрокарбонат
натрия
Na – O
( CaOH)2CO3 ( основная соль)
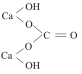
-карбонат гидроксокальция
ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Соли представляют собой твердые кристаллические вещества. Имеют широкий диапазон температур плавления и термического разложения.
По растворимости в воде различают растворимые, мало растворимые и практически нерастворимые соли. К растворимым относятся почти все соли натрия, калия и аммония, многие нитраты, ацетаты и хлориды, многие кислые соли.
Ряд солей растворимы также в спиртах, ацетоне, амидах кислот и др. органических растворителях.
Из водных растворов соли могут кристаллизоваться в виде кристаллогидратов, из неводных - в виде кристаллосольватов, например:
|
СаВг2 • ЗС2Н5ОН |
Данные о различных процессах, протекающих в водносолевых системах, о растворимости солей при их совместном присутствии в зависимости от температуры, давления и концентрации, о составе твердых и жидких фаз могут быть получены при изучении диаграмм растворимости водно-солевых систем.
|
Соль Цвет Агрегатное состояние |
|
AgCl белый тв. |
|
CuSO4 белый тв. |
|
CaSO4 белый тв. |
|
BaSO4 белый тв. |
|
CuS чёрный тв . |
|
HgS чёрный тв. |
|
PbS чёрный тв. |
|
FeS чёрный тв. |
|
KMnO4 тёмно-фиол. тв. |
|
CuSO4 • 7H2O голубой тв. |
