
- •Вопрос 1. Внутренняя энергия (u) – сумма кинетической и потенциальной энергий частиц, поступательной, колебательной и др., потенциальной энергии притяжения и отталкивания.
- •Вопрос 2. Химические реакции протекают с выделением или с поглощением энергии. Обычно эта энергия выделяется или поглощается в виде теплоты.
- •Вопрос 3. Энтропия – величина, пропорциональная логарифму количества микросостояний, соответствующих данному макросостоянию системы, мера беспорядка в системе.
- •Вопрос 4. Система – рассматриваемое вещество или совокупность веществ.
- •Вопрос 5. Зависимость скорости реакции
- •Вопрос 6. Все хим. Реакции можно разбить на 2 группы: обратимые и необратимые.
- •Вопрос 7. Если система находится в равновесии, то она из него может выйти только при изменении внешних условий.
- •Вопрос 8.
- •Вопрос 10. Квантованность энергетических состояний электрона в атоме есть следствие его волновых свойств.
- •Вопрос 11. Принцип Паули
- •Вопрос 12. Валентность элемента – это способность его атомов соединяться с другими атомами в определённых соотношениях.
- •Вопрос 14. При взаимодействии атомов между ними может появляться химическая связь, приводящая к образованию устойчивой многоатомной системы.
- •Вопрос 16. Ионная связь – крайний случай ковалентной полярной связи.
- •Вопрос 18. Химическая связь – такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
- •Вопрос 20. Гидролизом называется взаимодействие с водой, при котором составные части вещества соединяются с составными частями воды.
- •Вопрос 26. Коррозия металлов. Электрохимическая коррозия: анодные и катодные процессы, продукты коррозии. Примеры.
- •Вопрос 27. Методы защиты металлов от коррозии. Анодные и катодные покрытия.
- •Вопрос 28. Химические свойства металлов: взаимодействие с водой и кислотами.
Вопрос 16. Ионная связь – крайний случай ковалентной полярной связи.
Δ Э.О.>>>0
а) 1-ая группа подгруппа А (щелочные металлы).
б) 7-ая группа подгруппа А (галогены).
![]() -
связь – разновидность ковалентной
связи, которая возникает при перекрывании
атомных орбиталей вдоль оси, соединяющей
центры взаимодействующих атомов.
-
связь – разновидность ковалентной
связи, которая возникает при перекрывании
атомных орбиталей вдоль оси, соединяющей
центры взаимодействующих атомов.
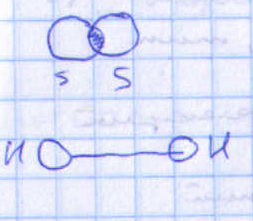

![]() -связь
– осуществляется при перекрывании
атомных орбиталей по обе стороны оси,
соединяющие ядра атомов и характеризуются
двумя областями перекрывания.
-связь
– осуществляется при перекрывании
атомных орбиталей по обе стороны оси,
соединяющие ядра атомов и характеризуются
двумя областями перекрывания.
![]() -
связь – возникает при перекрывании
двух d-орбиталей,
расположенных в параллельных плоскостях.
-
связь – возникает при перекрывании
двух d-орбиталей,
расположенных в параллельных плоскостях.
Вопрос 17. Гибридизация атомных орбиталей – изменение формы электронных облаков. Если в образовании нескольких химических связей участвуют различные атомные орбитали одного и того же атома, то исходные неравноценные атомные орбитали «перемешиваясь» образуют энергетически-равноценные орбитали. При этом происходит перераспределение электронной плотности, которая требует затрат энергии.
Гибридизация бывает 3-х видов:
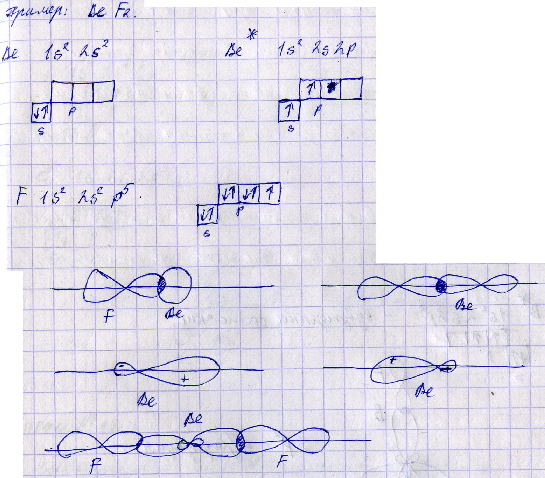
1) sp-гибридизация
sp-гибридизация образуется при связи s-орбитали и p-орбитали.
sp-орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы. Угол связи молекулы равен 1800.

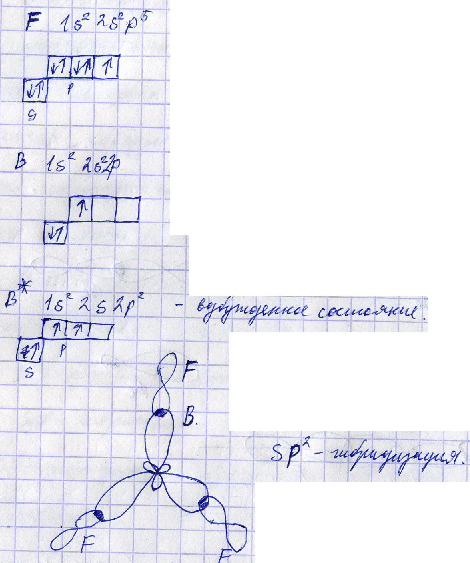
2) sp2-гибридизация
sp2-гибридизация образуется при связи s-орбитали и 2-х p-орбиталей.
В этом случае гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированы под углом 1200.
Очевидно, что этому типу гибридизации соответствует образование треугольной молекулы.
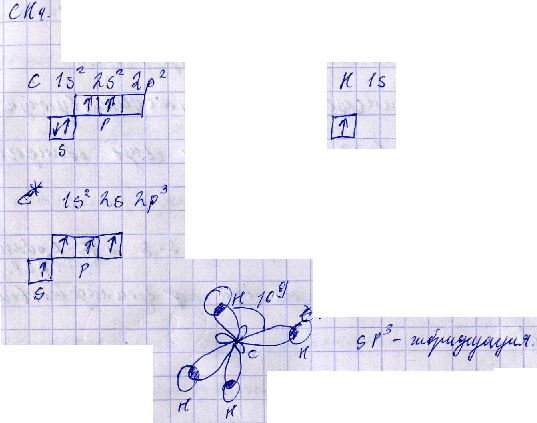
3) sp3-гибридизация
Если в гибридизации участвуют одна s и три p-орбитали, вытянутые к направлениям вершинам тетраэдра, т.е. ориентированы под углами 109О друг к другу, то такая гибридизация называется sp3-гибридизация.
Вопрос 18. Химическая связь – такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Насыщаемость – способность атомов образовывать строго определенное количество химических связей.
Направленность – линия, соединяющая центры взаимодействующих атомов, проходящих через повышенную электронную плотность.
Энергия связи – количество энергии необходимое для разрыва связи.
Длина связи – межъядерное расстояние. Чем меньше длина связи, тем прочнее связь.
Кратность связи – Чем больше кратность связи, тем больше значение энергии, тем меньше длина.
Полярность связи – показывает смещение общей электронной пары в сторону ядра более электроотрицательного элемента.
Вопрос 19. Согласно теории электрохимической диссоциации, при растворении в воде электролиты распадаются на положительные и отрицательно заряженные ионы. Как и молекулы растворителя, ионы в растворе находятся в состоянии неупорядоченного теплового движения. Процесс электрохимической диссоциации изображают пользуясь химическими уравнениями.
Кислоты:
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, можно объяснить присутствием гидроксированных ионов водорода. Это они сообщают кислотам кислый вкус.
Кислоты - электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, свойства кислот проявляются в большей степени, у слабых – в меньшей. Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее. Кислоты, константы диссоциации которых лежат в интервале 10-4 – 10-2, иногда называются средними кислотами.
Основания:
Основания – электролиты, диссоциирующие в растворах отщеплением гидроксид– ионов.
Сила оснований зависит, как и у кислот, от константы диссоциации чем она больше, тем сильнее основание.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать не только с кислотами, но и с основаниями. Гидроксиды обладающие такими свойствами называются амфотерными гидроксидами или амфотерными электролитами.
Соли:
Соли - электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от гидроксид- ионов.
Таких ионов, которые были бы для водных растворов всех солей нет; поэтому соли и не обладают общими свойствами.
При растворении кислых солей в растворе образуются катионы металлов, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы Н+.
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе такой соли присутствуют ОН.
