
- •Вопрос 1. Внутренняя энергия (u) – сумма кинетической и потенциальной энергий частиц, поступательной, колебательной и др., потенциальной энергии притяжения и отталкивания.
- •Вопрос 2. Химические реакции протекают с выделением или с поглощением энергии. Обычно эта энергия выделяется или поглощается в виде теплоты.
- •Вопрос 3. Энтропия – величина, пропорциональная логарифму количества микросостояний, соответствующих данному макросостоянию системы, мера беспорядка в системе.
- •Вопрос 4. Система – рассматриваемое вещество или совокупность веществ.
- •Вопрос 5. Зависимость скорости реакции
- •Вопрос 6. Все хим. Реакции можно разбить на 2 группы: обратимые и необратимые.
- •Вопрос 7. Если система находится в равновесии, то она из него может выйти только при изменении внешних условий.
- •Вопрос 8.
- •Вопрос 10. Квантованность энергетических состояний электрона в атоме есть следствие его волновых свойств.
- •Вопрос 11. Принцип Паули
- •Вопрос 12. Валентность элемента – это способность его атомов соединяться с другими атомами в определённых соотношениях.
- •Вопрос 14. При взаимодействии атомов между ними может появляться химическая связь, приводящая к образованию устойчивой многоатомной системы.
- •Вопрос 16. Ионная связь – крайний случай ковалентной полярной связи.
- •Вопрос 18. Химическая связь – такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
- •Вопрос 20. Гидролизом называется взаимодействие с водой, при котором составные части вещества соединяются с составными частями воды.
- •Вопрос 26. Коррозия металлов. Электрохимическая коррозия: анодные и катодные процессы, продукты коррозии. Примеры.
- •Вопрос 27. Методы защиты металлов от коррозии. Анодные и катодные покрытия.
- •Вопрос 28. Химические свойства металлов: взаимодействие с водой и кислотами.
Вопрос 1. Внутренняя энергия (u) – сумма кинетической и потенциальной энергий частиц, поступательной, колебательной и др., потенциальной энергии притяжения и отталкивания.
Внутренняя энергия является функцией состояния и не зависит от пути перехода.
U=U2-U1
A(г)+В(ж)=АВ; ΔНАВ - энтальпия образования вещества АВ
[ΔНАВ]=![]()
Это значит энтальпия образования сложного вещества из простых – количество выделившегося (поглотившегося) тепла, при образовании 1 моля сложного вещества.
I закон термодинамики: Теплота Q подведенная к системе расходуется на увеличение внутренней энергии системы и на совершение работы ею работы над внешними телами.
Дальше вопрос продолжается со слов Лабаскина И.П.(решайте сами надо вам это или нет):
Внутренняя энергия вещества (системы) – полная энергия частиц, составляющих данное вещество.
Она складывается из кинетической и потенциальной энергий частиц. Кинетическая энергия – это энергия поступательного, колебательного и вращательного движения частиц; потенциальная энергия обусловлена силами притяжения и отталкивания, действующими между частицами.
Внутренняя энергия зависит от состояния вещества. Изменение внутренней энергии системы ΔU при том или ином процессе можно определить. Пусть в результате какого-нибудь процесса система переходит из начального состояния 1 в конечное состояние 2, совершая при этом работу А и поглощая из внешней среды теплоту Q. Ясно, что внутренняя энергия системы уменьшится на величину А, возрастёт на величину Q и в конечном состоянии будет равна U2=U1+Q-A.
Если обозначить U2-U1=ΔU, то ΔU=Q-A.
Это уравнение выражает закон сохранения энергии, согласно которому изменение внутренней энергии не зависит от способа проведения процесса, а определяется только начальным и конечным состояниями системы.
Однако какая часть энергии пойдёт на совершение работы, а какая превратится в теплоту – зависит от способа проведения процесса: соотношение между работой и теплотой могут быть разными:
-
V=const
ΔU=Qu, где Qu – теплота, поглощенная системой в условиях постоянного объёма.
Это уравнение даёт возможность определять изменение внутренней энергии при различных процессах, например, в случае нагревания вещества при постоянном объёме изменение внутренней энергии определяется по теплоёмкости этого вещества:
ΔU=Qu=n Cu ΔT.
Здесь Сu – мольная теплоёмкость вещества при постоянном объёме; n – число молей вещества; ΔT – разность между конечной и начальной температурами.
В случае химической реакции, протекающей без изменения объёма системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
2) p=const
При постоянном давлении удобно пользоваться величиной энтальпией H, определяемой соотношением: H=U+pV.
При постоянном давлении и при условии, что в ходе процесса совершается только работа расширения (A=p ΔV)
ΔH= ΔU+P ΔV или ΔU= ΔH-p ΔV.
Сравнив последние выражения с выражением ΔU= Q-A, получаем ΔU= Qp.
Qp – количество теплоты, поглощённое системой при постоянном давлении.
Это уравнение даёт возможность определить изменение энтальпии при различных процессах.
Так, при нагревании вещества изменение его энтальпии определяется по теплоёмкости этого вещества при постоянном давлении
ΔU=Qp=n Cp ΔT, где
Ср – мольная теплоёмкость вещества при постоянном давлении, n – число моле вещества.
В случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту этой реакции, проведённой при постоянной температуре и постоянном давлении.
Между системой и внешними телами возможна передача энергии в форме теплоты и работы.
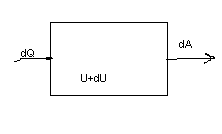
dQ=dU+dA – первый законтермодинамики.
Количество теплоты, полученное системой от окружающих тел, идёт на изменение её внутренней энергии и на совершение ею работы над внешними телами.
