
- •Первый закон Ньютона
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Импульс силы и импульс тела
- •Реактивное движение. Значение работ Циолковского для космонавтики
- •Работа силы (сил) над одной точкой
- •Механическая мощность
- •1 Ватт равен мощности силы, совершающей работу в 1 Дж за 1 секунду или, когда груз массой 100г поднимают на высоту 1м за 1 секунду
- •Формулы для решения:
- •Вывод основного уравнения мкт
Вывод основного уравнения мкт
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём.
Обозначим
скорость движения vx,
тогда перед столкновением со стенкой
сосуда импульс частицы
равен mvx,
а после — − mvx,
поэтому стенке передается импульс p =
2mvx.
Время, через которое частица сталкивается
с одной и той же стенкой, равно ![]() .
.
Отсюда следует:
![]()
Так
как давление ![]() ,
следовательно сила F = p * S
,
следовательно сила F = p * S
Подставив,
получим: ![]()
Преобразовав: ![]()
Так как рассматривается кубический сосуд, то V = Sl
Отсюда:
![]() .
.
Соответственно, ![]() и
и ![]() .
.
Таким
образом, для большого числа частиц верно
следующее: ![]() ,
аналогично для осей y и z.
,
аналогично для осей y и z.
Поскольку ![]() ,
то
,
то ![]() .
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
.
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
Отсюда ![]()
или ![]() .
.
Пусть ![]() —
среднее значение кинетической энергии
всех молекул, тогда:
—
среднее значение кинетической энергии
всех молекул, тогда:
![]() ,
откуда
,
откуда ![]() .
.
Для
одного моля выражение примет вид ![]()
Внутренняя энергия газа Ван дер Ваальса складывается из внутренней энергии самих молекул, составляющих газ, а также из кинетической энергии движения молекул и потенциальной энергии взаимного притяжения. Кинетическая энергия молекул определяется, как и для идеального газа, температурой и для одного моля газа равна C(V) * T.
При увеличении температуры (внутренней энергии молекул) газа возрастает их скорость и следственно давление с которым они воздействуют на окружающие предметы путем ударения с поверхностью этих предметов.
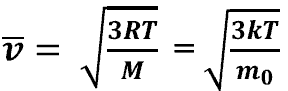
-
наиболее вероятную
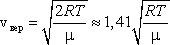
-
среднюю
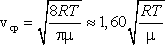
Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт явился одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
![]()
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
![]()
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
![]() ,
,
где S — энтропия, E — энергия термодинамической системы. Введённая таким образом величина T является одинаковой для различных тел при термодинамическом равновесии. При контакте двух тел тело с большим значением T будет отдавать энергию другому.
Абсолютный ноль определён как 0 K, что равно −273.15 °C (точно).
PV = nRT
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).
