
- •4.Пути использования глицина и серина
- •8.Строение кетоновых тел
- •9.Синтез гема
- •11.Транспортные формы, выделение углекислого газа из организма
- •Окислительное фосфорилирование адф. Механизм сопряжения окисления и фосфорилирования. Коэффициент окислительного фосфорилирования (р/о).
- •15. Функции слюны
- •1. Образование ацетил-sКоА из глюкозы, других моносахаров или кетогенных аминокислот.
- •2. Перенос ацетил-sКоА из митохондрий в цитозоль:
- •3. Образование малонил-sКоА из ацетил-sКоА.
- •4. Синтез пальмитиновой кислоты.
- •18.Минерализация костной ткани и твердых тканей зуба
- •Окислительное декарбоксилирование пирувата
- •Структурные гликопротеины.
- •Протеогликаны
- •Этапы минерализации костной ткани
8.Строение кетоновых тел
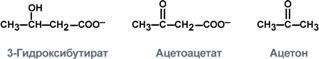
Кетоацидоз развивается при уменьшении концентрации инсулина крови, существенном недостатке углеводов в пище при достаточном или избыточном потреблении белков и жиров, при отравлении алкоголем, при голодании.
Механизм развития кетоацидоза состоит в избыточном окислении жирных кислот, поступающих в печень с пищей или из жировой ткани (активация липолиза) либо недостаточно эффективное сжигание "алкогольного" ацетил-SКоА.
Кетонемия (повышение концентрации кетоновых тел в крови) возникает при нарушении равновесия — скорость синтеза кетоновых тел превышает скорость их утилизации периферическими тканями организма.
Кетонурия Повышенное выведение кетоновых тел с мочой; наблюдается при сахарном диабете, отравлениях ацетоном, голодании
Диабетический кетоацидоз (ДКА) обусловливается резкой недостаточностью регуляторного действия инсулина на обмен глюкозы и жира. При ДКА к эффектам высокой гипергликемии добавляются последствия увеличения печеночного синтеза и поступления в кровь кетоновых тел, так что количество их намного превышает потребность периферических тканей в энергии. Основные кетоновые тела - ацетоуксусная и Р-гидроксимасляная кислоты - являются сильными органическими кислотами; гиперкетонемия вызывает метаболический ацидоз с последующей дыхательной компенсацией, а резкое повышение экскреции с мочой ацетоуксусной и бета-гидроксимасляной кислот неизбежно приводит к дополнительным потерям Na и К.. В результате спонтанного декарбоксилирования ацетоуксусной кислоты в плазме накапливается ацетон, который медленно выводится из организма через дыхательные пути.
Уровень свободных жирных кислот в плазме и их поступление в печень резко увеличиваются. В норме инсулин регулирует окисление свободных жирных кислот и кетогенез в печени за счет непрямого торможения транспорта КоА-производных длинноцепочечных жирных кислот через внутреннюю мембрану митохондрий в их матрикс. Эти производные, попав в митохондриальный матрикс, быстро окисляются, а повышение скорости их окисления в печени сверх определенного предела автоматически приводит к увеличению и высвобождению ацетоуксусной кислоты; большая, но непостоянная часть последней перед выходом в плазму восстанавливается до бета-гидроксимасляной кислоты. Глюкагон стимулирует транспорт ацил-КоА-производных длинноцепочечных жирных кислот и их окисление и кетогенез в митохондриях печени, а нормальный противодействующий эффект инсулина при ДКА отсутствует. Соотношение p-гидроксимасляной и ацетоуксусной кислот, в норме составляющее 3:1, при ДКА резко возрастает, достигая иногда 8:1.
Значение кетоновых тел для метаболизма головного мозга.
Ацетон в сущности являясь токсическим веществом для головного мозга, циркулирует в мизе́рной концентрации
Во время голодания кетоновые тела являются одним из основных источников энергии для мозга.
Кетоновые тела, синтез, утилизация, энергетическая ценность
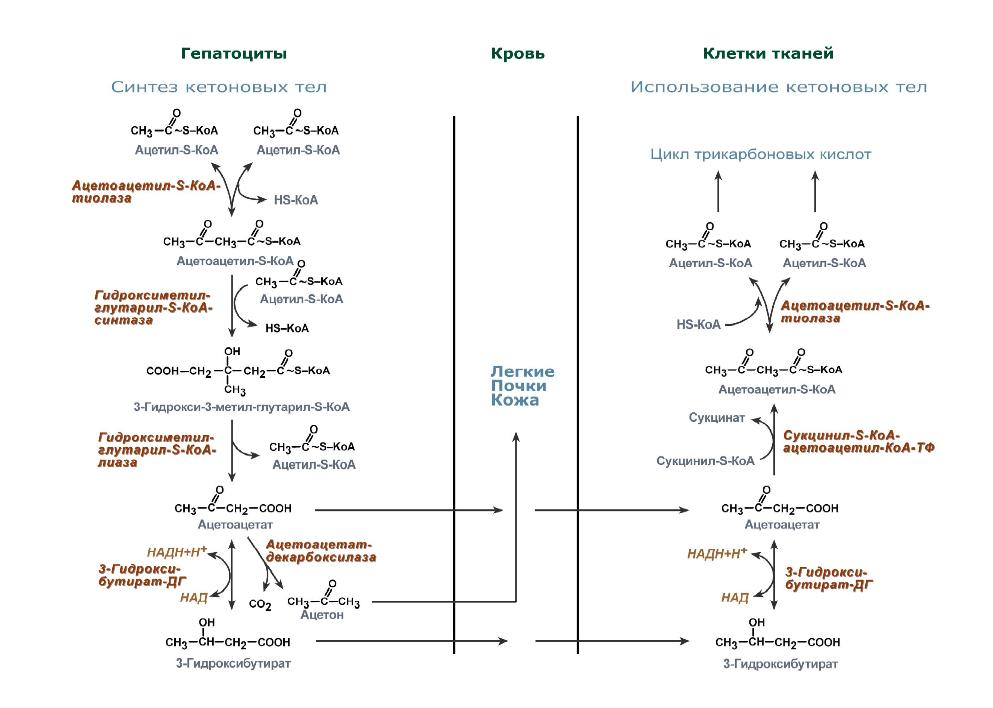
9.Синтез гема
Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях.
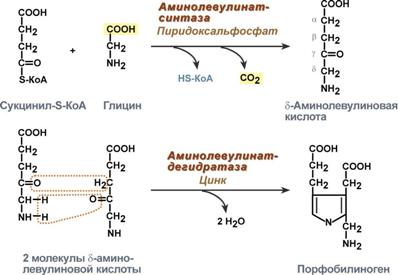
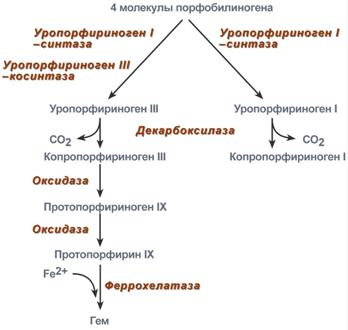
Протопорфирин IX связывания с железом образует гем
Достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента и блокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. Ионы железа связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс, что инициирует синтез фермента.
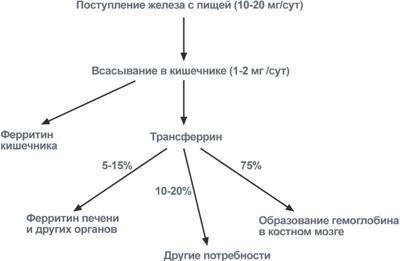
Метаболизм железа всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). При этом железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+ используется аскорбиновая кислота и соляная кислота.
После всасывания железо либо откладывается в клетках кишечника в составе ферритина (Fe3+), либо сразу попадает в кровоток и в комплексе с трансферрином (Fe3+) переносится в клетки печени, костного мозга или других тканей, где также связывается с ферритином. Вне связи с белками железо очень токсично, так как запускает свободно-радикальные реакции с образованием активных форм кислорода.
Гемоглобин(Гем)

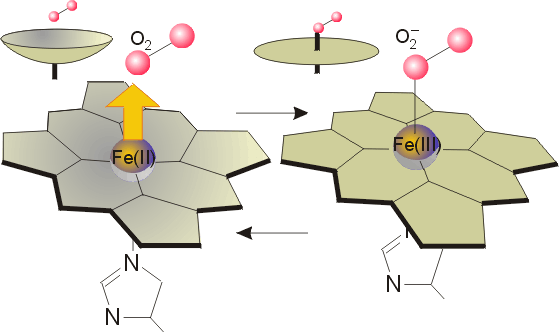 способный обратимо
связываться с кислородом,
обеспечивая его перенос в ткани
способный обратимо
связываться с кислородом,
обеспечивая его перенос в ткани
Миоглоби́н — кислород-связывающий белок скелетных мышц и мышцы сердца.
Цитохром- содержит ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками. Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах
Каталаза-фермент, который разлагает образующуюся в процессе биологического окисления перекись водорода на воду и молекулярный кислород (2H2O2 → 2H2O + O2), а также окисляет в присутствии перекиси водорода низкомолекулярные спирты и нитриты. Участвует в тканевом дыхании. Относится к хромопротеидам, имеющим в качестве простетической (небелковой) группы окисленный гем.
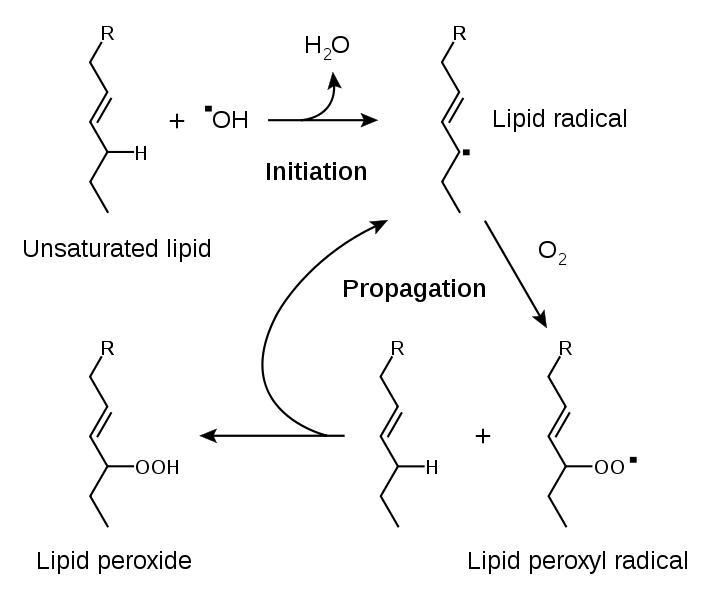
10.Процесс перекисного окисления липидов ( ПОЛ ) является важной причиной накопления клеточных дефектов. Основным субстратом ПОЛ являются полиненасыщенные цепи жирных кислот ( ПНЖК ), входящих в состав клеточных мембран , а также липопротеинов . Их атака кислородными радикалами ( АФК ) приводит к образованию гидрофобных радикалов, взаимодействующих друг с другом. Вначале происходит атака сопряженных двойных связей ненасыщенных жирных кислот со стороны НО* и НО2*, что приводит к появлению липидных радикалов.
Липидный радикал может реагировать с О2 с образованием пероксильного радикала, который, в свою очередь, взаимодействует с новыми молекулами ненасыщенных жирных кислот и приводит к появлению липидных пероксидов, которые достаточно стабильны при температуре тела.Скорость этих реакций зависит от активности антиоксидантной системы клетки. При взаимодействии с комплексами железа гидроперекиси липидов превращаются в активные радикалы, продолжающие цепь окисления липидов: LOOH + Fe2+ Fe(III) + OH- + LO* LO* + LH LOH + L*. Образующиеся липидные радикалы , а также 4-гидроксиноненаль и МДА, могут атаковать молекулы белков и нуклеиновых кислот. Альдегидные группы этих соединений образуют межмолекулярные сшивки, что сопровождается нарушением структуры макромолекул и дезорганизует их функционирование ( Aruoma, 1998 ).
Окисление липидов приводит к нарушению нормальной упаковки мембранного бислоя , что может вызвать повреждение и мембраносвязанных белков. Так, например, ПОЛ может приводить к инактивации мембранных рецепторов, а также таких ферментов, как глюкозо- 6-фосфатаза и Na/K-АТФаза, принимающая непосредственное участие в поддержании ионного гомеостаза клетки . В митохондриях могут повреждаться как ферменты матрикса, так и компоненты дыхательной цепи. Поврежденные мембраны утрачивают энергетический потенциал, электровозбудимую функцию, контроль за ионными потоками и медиаторными системами, возникают патологические (воспалительные, нейродегенеративные, злокачественные) изменения в тканях, что, в конце концов, приводит организм к гибели. Пероксинитрит , индуцирует процессы ПОЛ в мембранах липопротеинах сыворотки крови , что усиливает их захват макрофагами и лежит в основе атерогенеза.
Прооксиданты
Окисление углеводородов, спиртов, кислот, жиров и др. кислородом воздуха представляет собой цепной процесс. Цепные реакции превращений осуществляются с участием активных свободных радикалов — перекисных (RO2*), алкоксильных (RO*), алкильных (R*), а также активных форм кислорода (супероксид анион, синглетный кислород). Для цепных разветвлённых реакций окисления характерно увеличение скорости в ходе превращения (автокатализ). Это связано с образованием свободных радикалов при распаде промежуточных продуктов — гидроперекисей и др.
Механизм действия наиболее распространённых антиоксидантов (ароматические амины, фенолы, нафтолы и др.) состоит в обрыве реакционных цепей: молекулы антиоксиданта взаимодействуют с активными радикалами с образованием малоактивных радикалов
В полости рта
Антиоксидантные витамины E и C наряду с каротиноидами (напр. бета-каротин), снижают активность оксидативного стресса в клетках и тканях организма. Они усиливают иммунную защиту десен и предупреждают инвазию микробов в слизистую ротовой полости. Исследования выявили зависимость между низким уровнем антиоксидантов в сыворотке крови и увеличением встречаемости периодонтита (12, 13). Недостаточное содержание витамина C повышает риск повреждения десен и периодонтального связочного аппарата. Соответственно, адекватное поступление витамина C в организм может предупредить развитие этих нарушений (14, 15). Одно из типичных проявлений тяжелого гиповитаминоза C - это цинга; при недостаточности витамина C не редко развивается гингивит (повышенная кровоточивость десен).
