
- •4.Пути использования глицина и серина
- •8.Строение кетоновых тел
- •9.Синтез гема
- •11.Транспортные формы, выделение углекислого газа из организма
- •Окислительное фосфорилирование адф. Механизм сопряжения окисления и фосфорилирования. Коэффициент окислительного фосфорилирования (р/о).
- •15. Функции слюны
- •1. Образование ацетил-sКоА из глюкозы, других моносахаров или кетогенных аминокислот.
- •2. Перенос ацетил-sКоА из митохондрий в цитозоль:
- •3. Образование малонил-sКоА из ацетил-sКоА.
- •4. Синтез пальмитиновой кислоты.
- •18.Минерализация костной ткани и твердых тканей зуба
- •Окислительное декарбоксилирование пирувата
- •Структурные гликопротеины.
- •Протеогликаны
- •Этапы минерализации костной ткани
1. Метаболизм (обмен веществ) бактерий представляет собой совокупность 2 взаимосвязанных противоположных процессов: катаболизма и анаболизма.Катаболизм(диссимиляция) — распад веществ в процессе ферментативных реакций и накопление выделяемой при этом энергии в молекулах АТФ.Анаболизм(ассимиляция) — синтез веществ с затратой энергии. Особенности метаболизма у бактерий состоят в том, что:• его интенсивность имеет достаточно высокий уровень, что возможно обусловлено гораздо большим соотношением поверхности к единице массы, чем у многоклеточных;• процессы диссимиляции преобладают над процессами ассимиляции;• субстратный спектр потребляемых бактериями веществ очень широк — от углекислого газа, азота, нитритов, нитратов до органических соединений, включая антропогенные вещества — загрязнители окружающей среды (обеспечивая тем самым процессы ее самоочищения);• бактерии имеют очень широкий набор различных ферментов — это также способствует высокой интенсивности метаболических процессов и широте субстратного спектра.Ферменты бактерий по локализации делятся на 2 группы:• экзоферменты — ферменты бактерий, выделяемые во внешнюю среду и действующие на субстрат вне клетки (протеазы, полисахариды, олигосахаридазы);• эндоферменты — ферменты бактерий, действующие на субстраты внутри клетки (расщепляющие аминокислоты, моносахара, синтетазы).Синтез ферментов генетически детерминирован, но регуляция их синтеза идет за счет прямой и обратной связи, т. е. для одних —репрессируется, а для других — индуцируется субстратом. Ферменты, синтез которых зависит от наличия соответствующего субстрата в среде (бета-галактозидаза, бета-лактамаза), называются индуцибельными.Другая группа ферментов, синтез которых не зависит от наличия субстрата в среде, называется конститутивными (ферменты гликолиза). Их синтез имеет место всегда, и они всегда содержатся в микробных клетках в определенных концентрациях. Изучают метаболизм бактерий с помощью физико-химических и биохимических методов исследования в процессе культивирования бактерий в определенных условиях на специальных питательных средах, содержащих то или иное соединение в качестве субстрата для трансформации.Такой подход позволяет судить об обмене веществ путем более , детального изучения процессов различных видов обмена (белков, углеводов) у микроорганизмов. Бактерии Streptococcus mutans, вызывающие кариес, потрясли научную общественность, передает dentaclass.ru. Оказалось, что они способны существовать без биохимического механизма, до сих пор считавшегося жизненно необходимым. С помощью механизма SRP (signal recognition particle) происходит транспортировка белков и их встраивание в клеточную мембрану. При нарушении этого процесса мембрана ослабевает и теряет способность защищать клетку от факторов внешней среды. При попадании в ротовую полость человека сахаросодержащих веществ населяющие ее S.mutans начинают активно размножаться, синтезируя при этом молочную кислоту. Повышенная кислотность убивает полезные бактерии и разрушает зубную эмаль
Исследователи университета штата Флорида решили выяснить, на чем основывается способность этих бактерий выживать в синтезируемой ими самими кислоте. Для этого они поочередно блокировали гены бактерий, наблюдая за производимым эффектом. Блокирование SRP ухудшало способность бактерий адаптироваться к резким изменениям окружающей среды, но, к огромному удивлению ученых, совсем не мешало им в отсутствие стресса. Нарушение жизнедеятельности S.mutans в нормальных условиях было достигнуто только при одновременном блокировании SRP-механизма и синтеза YidC2 ? белка, являющегося, по-видимому, альтернативной заменой SRP. Авторы считают, что гены SRP и YidC2 могут быть использованы в качестве мишеней для лечения не только кариеса, но и других инфекционных заболеваний. Зубная бляшка является мягким аморфным гранулированным отложением, которое накапливается на поверхностях зубов, пломбах, протезах и зубном камне. Она плотно прилипает к поверхности, расположенной под ней, от которой ее мож¬но отделить только путем механической чистки. Полоскание и воздушные струи полностью не удаляют ее. В малых количествах бляшка не видна, если только она не пигментирована. Когда она накапливается в больших количествах, то становит¬ся видимой шаровидной массой серого или желто-серого цвета. Образование зубной бляшки начинается с присоединения монослоя бакте¬рий к пелликуле зуба. Микроорганизмы прикрепляются к зубу с помощью межбак¬териального матрикса, состоящего, в основном, из комплекса полисахаридов и протеинов, и. в меньшей степени из липидов. По мере роста бляшки ее микробная флора изменяется от преобладания кокковых (главным образом положительных) до более сложной популяции с большим содержанием палочковых микроорганиз-мов. По мере того как бляшка утолщается, внутри нее создаются анаэробные усло¬вия и, соответственно, изменяется флора. Это приводит к тому, что на 2-3 день, с момента ее образования, появляются граммотрицательные кокки и палочки. Бляшка не является остатком пищи, но бактерии бляшки используют введен¬ные питательные вещества для образования компонентов матрикса. Так, при обиль¬ном поступлении углеводов с пищей, образованные внеклеточные полисахариды закрывают межклеточные пространства в бляшке и способствуют накоплению в ней органических кислот.
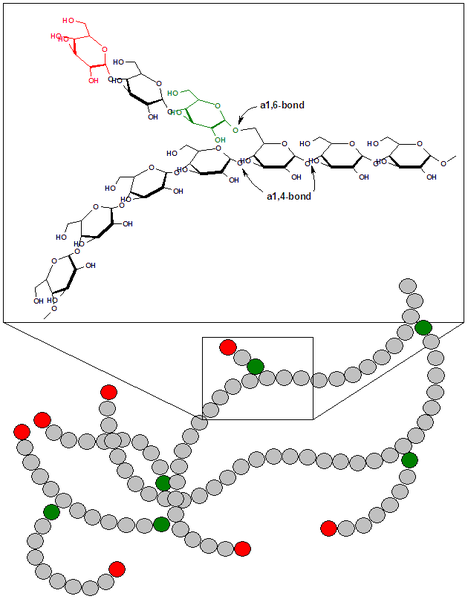
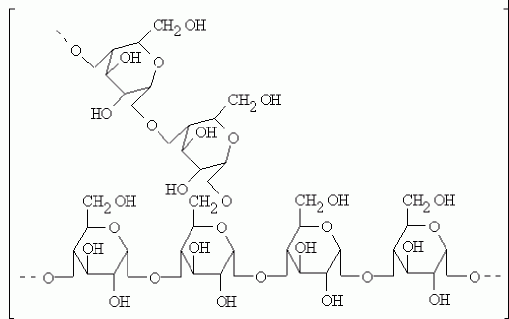
2. Распад гликогена происходит при участии двух ферментов: гликогенфосфорила-зы и фермента с двойной специфичностью — 4:4-трансферазы/а-1,6-гликозидазы.Гликогенфосфорилаза катализирует фосфоролиз 1,4-гликозидной связи нере-дуцирующих концов гликогена (рис. 9.19): глюкозные остатки отщепляются один за другим в форме глюкозо-1-фосфата. При этом гликогенфосфорилаза не может отщеплять глюкозные остатки от коротких ветвей, содержащих менее пяти глюкозных остатков; такие ветви удаляются 4:4-транс-феразой/а-1,6-гликозидазой. Этот фермент катализирует перенос фрагмента из трех остатков короткой ветви на концевой глюкоз-ный остаток более длинной ветви (рис. 9.20); кроме того, он гидролизует 1,6-гликозидную связь и таким образом удаляет последний остаток ветви. Голодание в течение 24 ч приводит практически к полному исчезновению гликогена в клетках печени. Однако при ритмичном питании каждая молекула гликогена может существовать неопределенно долго: при отсутствии пищеварения и поступления в ткани глюкозы молекулы гликогена уменьшаются за счет расщепления периферических ветвей, а после очередного приема пищи вновь вырастают до прежних размеров. Аналогичные процессы происходят и в мышечной ткани, но здесь они в значительной мере определяются режимом мышечной работы. Глюкозо-1-фосфат, образующийся из гликогена, при участии фосфоглюкомута-зы превращается в глюкозо-6-фосфат, дальнейшая судьба которого в печени и в мышцах различна. В печени глюкозо-6-фосфат превращается в глюкозу при участии глюкозо-6-фосфатазы, глюкоза выходит в кровь и используется в других органах и тканях. В мышцах нет этого фермента, поэтому глюкозо-6-фосфат используется здесь же, в мышечных клетках, распадаясь аэробным или анаэробным путем. Поскольку синтез и распад гликогена протекают по различным метаболическим путям, эти процессы могут контролироваться реципрокно. Влияние гормонов на синтез и распад гликогена осуществляется путём изменения в противоположных направлениях активности двух ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования (рис. 7-27).Гликогенфосфорилаза существует в 2 формах:1) фосфорилированная - активная (форма а); 2) дефосфорилированная - неактивная (форма в).Фосфорилирование осущеспшяется путём переноса фосфатного остатка с АТФ на гидроксильную группу одного из сериновых остатков фермента. Следствие этого - конформационные изменения молекулы фермента и его активация. Взаимопревращения 2 форм гликогенфосфорилазы обеспечиваются действием ферментов киназы фосфорилазы и фосфопротеинфосфатазы (фермент, структурно связанный с молекулами гликогена). В свою очередь, активность киназы фосфорилазы и фосфопротеинфосфатазы также регулируется путём фосфорилирования и дефосфорилирования.Активация киназы фосфорилазы происходит под действием протеинкиназы А - ПКА (цАМФ-зависимой). цАМФ сначала активирует протеинкиназу А, которая фосфорилирует киназу фосфорилазы, переводя её в активное состояние, а та, в свою очередь, фосфорилирует гликогенфосфорилазу. Синтез цАМФ стимулируется адреналином и глюкагоном (см. раздел 5).Активация фосфопротеинфосфатазы происходит в результате реакции фосфорилирования, катализируемой специфической протеинкиназой, которая, в свою очередь, активируется инсулином посредством каскада реакций с участием. Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме.
Присоединение фосфатов к ферменту производят протеинкиназы, источником фосфора является АТФ:фосфорилаза гликогена активируется после присоединения фосфатной группы,синтаза гликогена после присоединения фосфата инактивируется.Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз, активируя фосфорилазу гликогена. Гликогенозы — общее название синдромов, обусловленных наследственными дефектами ферментов, участвующих в синтезе или расщеплениигликогена.
Гликогенозы. Если нарушена мобилизация гликогена, то гликоген накапливается в клетках в больших количествах, что может привести к разрушению клеток. Такие гликогеновые болезни называют гликогенозами. Известно несколько типов гликогенозов, связанных с недостаточностью разных ферментов или одного и того же фермента в разных органах. В табл. 9.1 перечислены некоторые наиболее изученные типы гликогенозов.Клинические симптомы гликогенозов характерны для каждого типа болезни. Наиболее часто наблюдаются увеличение печени, мышечная слабость, гипоглю-коземия натощак. Продолжительность жизни больных, как правило, уменьшена, нередко смерть наступает в раннем детстве. Агликогенозы. Если нарушен синтез гликогена (например, вследствие дефекта гликогенсинтетазы), то содержание гликогена в клетках понижено: эти формы гли-когеновых болезней называют агликогенозами. Самый характерный симптом аглико-генозов — резкая гипоглюкоземия натощак (поскольку нет запасов гликогена), особенно после ночного перерыва в кормлении. В результате гипоглюкоземии могут возникать рвота, судороги, потеря сознания. Постоянное голодание мозга приводит к отставанию умственного развития. Обычно эти больные погибают в раннем детстве; частые кормления могут существенно ослабить проявления болезни. Исследование показало, что распределение гликогена в эпителиальном пласте у людей с интактными зубными рядами характеризуется определенной закономерностью. В базальном слое и примыкающих к нему 20— 26 рядах шиповатых клеток он не выявляется. Включения его обнаруживаются в клетках зернистого слоя в поверхностных рядах шиповатых и постепенно увеличиваются по мере приближения к ороговевшим клеткам. В роговом слое гликоген не выявляется.В указанных слоях эпителия включения гликогена распределялись неравномерно. Встречаются участки в виде небольших островков, в которых клеточные элементы содержат значительное количество гранул гликогена, а рядом с ними находились клетки, лишенные глыбок гликогена. Включения гликогена в цитоплазме эпителиальных клеток имеет различную форму. В большинстве случаев они представлены глыбками неодинаковой величины и зернами.Обращает на себя внимание частая концентрация гликогена на одном из полюсов клетки в виде полулуния. В клетках и межклеточном веществе, подлежащей соединительной ткани у людей с интактными зубными рядами гликогена не обнаружено.В эпителии различных зон слизистой оболочки твердого неба количество гликогена неодинаково. В основном он выявляется в передней трети твердого неба. Следует подчеркнуть, что изменений в содержании и распределении гликогена в зависимости от возраста нами не отмечено.
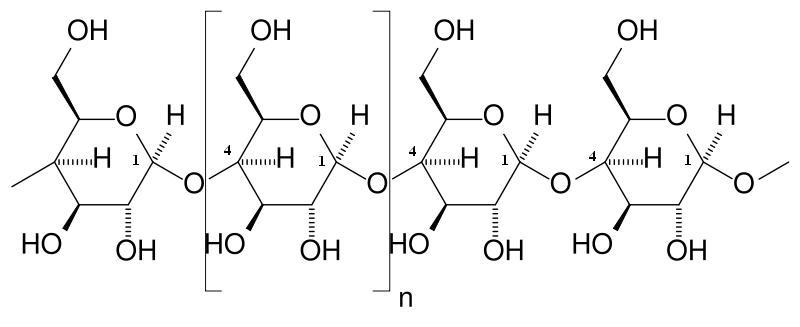
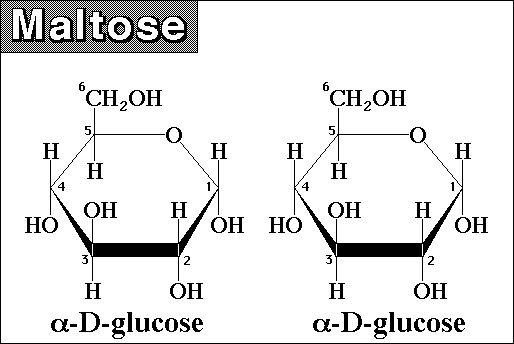
3. Слюна, содержит пищеварительные ферменты: α-амилазу и мальтазу, а также непищеварительные ферменты:калликреин и лизоцим. Твердая пища, попадающая в полость рта, измельчается и перемешивается со слюной. Слюна содержит пищеварительные ферменты α-амилазу (α - амилаза) и мальтазу. Альфа-амилаза гидролизует крахмал и гликоген с образованием мальтозы (~20% конечного продукта гидролиза), мальтотриозы, а также смеси разветвлённых олигосахаридов (α-декстрины), неразветвлённых олигосахаридов и некоторогоколичества глюкозы (вместе ~80% конечного продукта гидролиза). Альфа-амилаза, как и любые другие ферментысекретируется железистыми клетками и резервируется в неактивной форме и активируется при выведении. Для активацииα-амилазы необходимы анионы хлора. Интенсивность и продолжительность гидролиза углеводов зависит от щёлочностисреды. Пределы уровня щелочности оптимальные для максимального действия α-амилазы pH = 6,6 ÷ 6,8. Мальтаза слюны действует на углевод мальтозу, расщепляя её до глюкозы. Пределы уровня щелочности оптимальные для максимального действия мальтазы pH = 5,8 ÷ 6,2. При продвижении из полости рта в желудок пищевой комок вклинивается в толщу ранее принятой пищи, находящейся в желудке. Это на некоторое время может задержать изменение среды пищевого комка со щелочной на кислую, обусловленное перемешиванием с соляной кислотой желудочного сока. В таких условиях щелочной среды ферменты слюны продолжают гидролиз крахмала и гликогена. В полости желудка переваривается ~30 ÷ 40% всех углеводов, поступивших с пищей. Постепенно соляная кислота с поверхности перемешивается с содержимым желудка, и его щелочная среда меняется на кислую. Амилаза и мальтаза слюны инактивируются. Последующее расщепление углеводов осуществляется ферментами сока поджелудочной железы при переходе химуса в тонкую кишку.
Свойства пищеварительных ферментов. Ферменты слюны действуют на сложные углеводы, они превращают крахмал в глюкозу: крахмал нерастворим,он не может всасываться в кровь, а глюкоза может. Ферменты ротовой полости действуют в слабощелочной или нейтральной среде, ферменты желудка – в кислой, кишечные ферменты – в слабощелочной среде. Ферменты слюны действуют на крахмал, ферменты желудочного сока – на белки, ферменты кишечного сока – на белки, жиры, углеводы. Они расщепляют эти вещества до продуктов, способных всосаться в кровь или лимфу. Особенно высокой ферментативной активностью обладает осадок слюны. Его способность задерживаться и накапливаться в ретенционных пунктах ведет к возникновению зон с высокой метаболической активностью, накоплением больших концентраций кислот и других продуктов метаболизма.
-
Количество нерастворимого осадка в слюне лиц, резистентных к кариесу, составляет 6,76+0,38 г/100 мл слюны.
Ферментативная активность осадка и надосадочной фракции смешанной слюны
|
|
КФ |
ЩФ |
Альдолаза |
АЛТ |
АСТ |
|
Осадок: |
4,0 |
0,4 |
50 |
0,9 |
1,6 |
|
Н/О: |
1,0 |
0,3 |
15 |
0,3 |
0,3 |
При заболеваниях полости рта ферментативная активность слюны изменяется. У больных с единичным и, особенно, с множественным кариесом зубов снижается активность гистидиндекарбоксилазы в слюнных железах, что ведет к снижению синтеза и выделения гистамина. Резко падает активность лизоцима в паротидной и смешанной слюне.
Ранним проявлением клеточного повреждения, в основном - клеток эпителия, является повышение активности аспартатаминотрансферазы (АсАТ) в ротовой жидкости, поскольку известно, что активность этого фермента в эпителии весьма высока, а в фибробластах и лейкоцитах в 5-6 раз ниже. Изменение уровня амилазы говорит о патологии поджелудочной железы. Этот показатель, как правило, повышается при остром панкреатите, закупорке протока поджелудочной железы камнями, спайками или опухолью. Иногда уровень амилазы возрастает при почечной недостаточности. Снижение уровня амилазы в крови может свидетельствовать о гепатите, повышении уровня гормонов щитовидной железы. Повышение содержания глюкозы наблюдается при сахарном диабете. Определение диастазы в моче производят в свежевыпущенной моче. Значительное повышение содержания этого фермента в крови и моче, достигающее иногда в моче 8000-16 000 ед. и более, наблюдается, как правило, при остром панкреатите. Это объясняется повышенным поступлением диастазы в кровь из поврежденной железы. Такой резкий подъем диастазы бывает кратковременным и держится несколько суток, а затем уровень снижается до нормальных величин, хотя патологический процесс в железе продолжается. Между уровнем содержания диастазы в моче и крови в большинстве случаев наблюдается параллелизм, за исключением случаев, когда в процесс вовлечены почки. При заболеваниях почек диастаза плохо выделяется с мочой: повышение количества диастазы в крови может не сопровождаться повышенным содержанием ее в моче. Сбор суточной мочи для биохимического анализа. Первую утреннюю порцию мочи удаляют. Отмечают время. Все последующие порции мочи, выделенные в течение дня, ночи и утреннюю порцию следующего дня (через 24 часа от начала сбора) собирают в одну ёмкость, которая хранится в холодильнике (+4...+8°С) в течение всего времени сбора. При комнатной температуре стабильность аналитов снижается. После завершения сбора следует точно измерить объём собранной за сутки мочи, обязательно перемешать и сразу же отлить в сухую чистую пробирку, около 5 мл. На исследование в лабораторию необходимо доставить именно контейнер для мочи. На направительном бланке нужно указать суточный объём мочи (диурез) в миллилитрах и время сбора (часов). Например: «Диурез (мл) - 1500» – 24 ч. Сбор мочи за 2 часа для исследования амилазы мочи. Сбор мочи производится аналогично сбору суточной мочи, только в течение более короткого промежутка времени (например, 2 часа). После любого произвольного мочеиспускания отмечают время (эту порцию мочи удаляют). В течение следующих 2 часов всю мочу собирают в ёмкость. По окончании сбора обязательно перемешивают, после чего сразу же отливают в сухую чистую пробирку около 5 мл. На исследование в лабораторию необходимо доставить именно контейнер для мочи. На направительном бланке нужно указать суточный объём мочи (диурез) в миллилитрах и время сбора (часов). Например: «Диурез (мл) - 200» – 2 ч..Активность амилазы в кролви определяют Амилаза-Ново.
Амилаза.
Мальтаза.
Амилопектин.
4.Пути использования глицина и серина
Несмотря на простоту строения, глицин и серин являются весьма востребован-ными аминокислотами в клетках. Они могут превращаться друг в друга.
Роль реакции превращения серина в глицин состоит в образовании активной
Формы ТГФК-N5,N10-метилен-ТГФК.
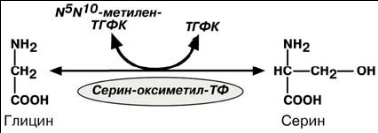

ВЗАИМОСВЯЗЬ ОБМЕНА ГЛИЦИНА, СЕРИНА И МЕТИОНИНА
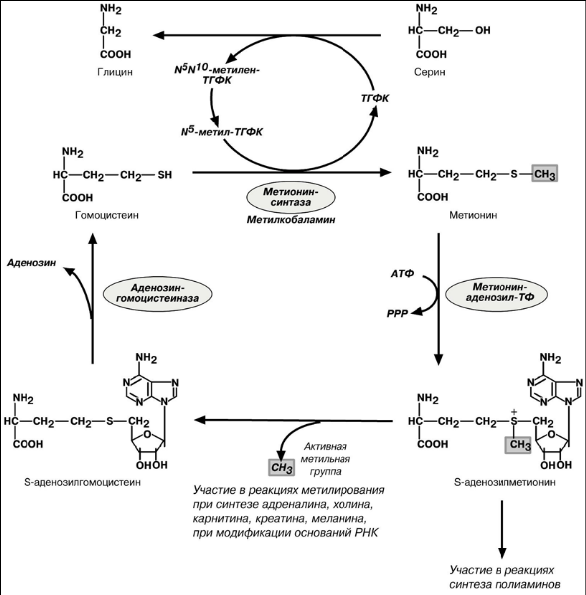
Реакции метилирования являются распространенными в организме. Они необхо-димы для синтеза ряда веществ – креатина, холина, карнитина, адреналина, фос-фатидилхолина, нуклеотидов в ДНК и РНК, гистонов, чужеродных веществ, в том числе лекарственных соединений. Источником метильной группы для этих реакций является S-аденозилметионин и производные тетрагидрофолиевой кислоты (ТГФК).
Образованный в реакции распада серина до глицина N5,N10-метилен-ТГФК пре-вращается в N5-метил-ТГФК. N5-Метил-ТГФК участвует в реакции реметилирования гомоцистеина в метионин. Последний впоследствии присоединяет аденозильный ос-таток и превращается в активную форму метионина – S-аденозилметионин, участ-вующий во многих реакциях метилирования.
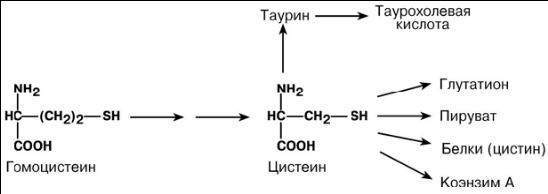
ПУТИ ИСПОЛЬЗОВАНИЯ ЦИСТЕИНА
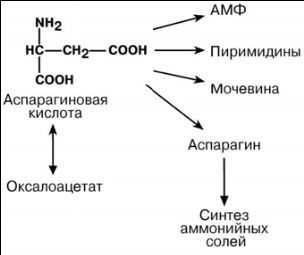
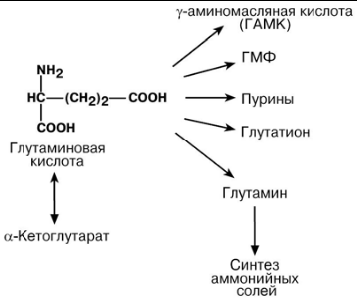
ПУТИ ИСПОЛЬЗОВАНИЯ ГЛУТАМИНОВОЙ И АСПАРАГИНОВОЙ КИСЛОТ
Деградация аминокислот: общие сведения
Углеродные скелеты 20 белковых аминокислот (см. с. 66) превращаются в итоге в семь различныхпродуктов деградации (на схеме окрашены в розовый и светло-голубой цвета). Пять метаболитов (2-оксоглутарат, сукцинил-КоА, фумарат, оксалоацетат и пируват) служат предшественниками в процессе глюконеогенеза (см. с. 156). Первые четыре являются еще и промежуточными продуктами цитратного цикла, в то время как пируват может быть переведен пируватдекарбоксилазой в оксалоацетат и тем самым стать участником глюконеогенеза (зеленая стрелка). Аминокислоты, деградация которых поставляет один из пяти упомянутых метаболитов, называются глюкогенными аминокислотами. За двумя исключениями (лизин и лейцин, см. ниже) глюкогенными являются все белковые аминокислоты.
Два других продукта распада (ацетоацетат и ацетил-КоА) не могут включаться в глюконеогенез в организме животных. Они используются для синтеза кетоновых тел, жирных кислот и изопреноидов (см. сс. 174, 304). Поэтому аминокислоты, которые разрушаются с образованием ацетил-КоА или ацетоацетата, называются кетогенными аминокислотами. Фактически кетогенными являются только лейцин и лизин. Некоторые аминокислоты поставляют продукты деградации, являющиесяглюкогенами и кетогенами. К этой группе принадлежат фенилаланин, тирозин, триптофан и изолейцин.
Существует несколько путей удаления аминогруппы во время распада аминокислоты (дезаминирования). Обычно NH2-группа переносится путем трансаминирования на 2-оксоглутарат (см. с. 180, желтые метки на схеме). Образующийся глутамат в дальнейшем вновь превращается в 2-оксоглутарат с помощью глутаматдегидрогеназы (окислительное дезаминирование, зеленая метка). В этой реакции образуется свободный аммиак (NH3), который у высших животных превращается в мочевину и выводится из организма (см. с. 184). Аммиак освобождается также при гидролизе амидных групп аспарагина и глутамина (гидролитическое дезаминирование, оранжевая метка). Другим превращением, при котором образуется NH3, является элиминирующее дезаминированиесерина в пируват (голубая метка, см. с. 402).
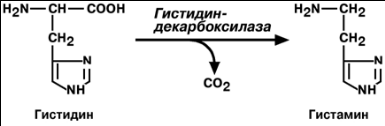
ДЕКАРБОКСИЛАЗА АМИНОКИСЛОТ
фермент, катализирующий декарбоксилирование (отщепление СО2 от карбоксильной группы) аминокислот. Ко-ферментом Д. а. является пиридоксаль-5-фосфат — производное витамина B6 (пиридоксина).
Г И С Т А М И Н
Реакция образования гистамина наиболее активно идет в тучных клетках,
филах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных
гранулах.
В кровь гистамин выделяется при повреждении ткани, при ударе, электрическом
раздражении. В клинической практике секреция гистамина обычно связана с аллер-
гиями – при повторном попадании антигена в ранее сенсибилизированный организм
развивается аллергическая реакция.
Физиологические эффекты
1. Расширение артериол и капилляров. Как следствие – покраснение кожи, сни-
жение артериального давления;
2. Повышение проницаемости стенки капилляров. Как следствие, выход жидкости
в межклеточное пространство – отечность, снижение артериального давления;
3. Если п.п.1 и 2 наблюдаются в головном мозге – повышение внутричерепного
давления;
4. Увеличивает тонус гладких мышц бронхов. Как следствие – спазм и удушье;
5. Слабо повышает тонус мышц желудочно-кишечного тракта.
6. Стимулирует секрецию слюны и желудочного сока.
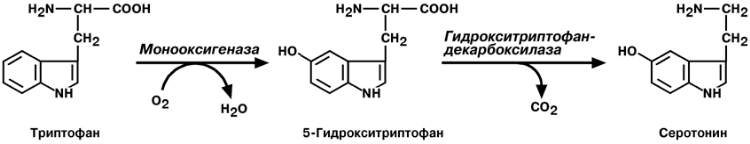
С Е Р О Т О Н И Н
Серотонин активно синтезируется в тучных клетках кожи, в селезенке, ЦНС, лег-
ких, печени.
Физиологические эффекты
1. Стимулирует сокращение гладких мышц желудочно-кишечного тракта. Как
следствие, повышение перистальтики ЖКТ;
2. Выражено стимулирует сокращение гладких мышц сосудов, кроме сосудов
миокарда и скелетных мышц. Как следствие, повышение артериального давления;
3. Слабо увеличивает тонус гладких мышц бронхов;
4. В центральной нервной системе является тормозным медиатором;
5. В периферических нервных окончаниях обуславливает возникновение боли и
зуда (например, при укусе насекомых).
Г А М М А - А М И Н О М А С Л Я Н А Я К И С Л О Т А
Синтез γ-аминомасляной кислоты происходит в центральной нервной системе, в
подкорковых образованиях головного мозга (гипоталамус, черная субстанция, блед-
ный шар).

Физиологические эффекты
В центральной нервной системе является тормозным медиатором;
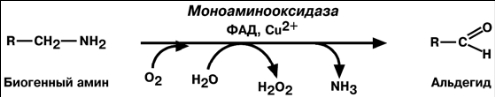
О Б Е З В Р Е Ж И В А Н И Е Б И О Г Е Н Н Ы Х А М И Н О В
Реакции инактивация биогенных аминов протекают с образованием свободного
аммиака и ФАДН2. Катализирует реакцию моноаминоксидаза, она обнаружена во
многих тканях, но наиболее активна в печени, желудке, почках, кишечнике, нервной
ткани.
Упрощенная схема транспорта кислорода и углекислого газа в организме при нормальных условиях выглядит следующим образом: во время вдоха кислород проникает через альвеолярную легочную мембрану и связывается с гемоглобином красных клеток крови — эритроцитов. Эритроциты доставляют кислород к тканям. Там гемоглобин, восстанавливаясь, отдает кислород и присоединяет углекислый газ. Возвращаясь в лёгкие, гемоглобин вновь окисляется и отдает углекислый газ, который удаляется из организма с выдохом.
Аминооксидазы условно выделяют в два класса: моноаминооксидазы (сокращённо - МАО), катализирующие распад веществ с одной аминогруппой, и полиаминооксидазы, расщепляющие вещества с двумя и более аминогруппами. Например, МАО осуществляет разрушение катехоламинов - адреналина, норадреналина, дофамина и других. МАО прикреплены к мембранам внутриклеточных органелл - митохондрий, и поэтому они разрушают только те катехоламины, которые локализуются внутри клеток.
5.Зубная эмаль (или просто эмаль) — внешняя защитная оболочка верхней части зубов человека.
Эмаль является самой твёрдой тканью в организме человека, что объясняется высоким содержанием неорганических веществ — до 97 %. Воды в зубной эмали меньше, чем в остальных органах, 2—3 %. Твёрдость достигает 397,6 кг/мм² (250—800 по Виккерсу). Толщина слоя эмали отличается на различных участках коронковой части зуба и может достигать 2,0 мм, а у шейки зуба сходит на нет.
Химический состав
Твёрдость зубной эмали определяется высоким содержанием в ней неорганических веществ (до 97 %), главным образом кристаллов апатитов: гидроксиапатита — Ca10(PO4)6(OH)2 (до 75,04 %), карбонатапатита (12,06 %), хлорапатита (4,397 %), фторапатита (3,548 %), CaCO3 (2,668 %), MgCO3(2,287 %) и др. Здоровая эмаль содержит 3,8 % свободной воды и 1,2 % органических веществ (белков, липидов, углеводов). Углеводы эмали представлены глюкозой, маннозой, галактозой и др. Вода занимает свободное пространство в кристаллической решётке и органической основе, а также располагается между кристаллами.
Гидроксиапатиты очень восприимчивы к кислотам, поэтому разрушение эмали начинается уже при pH 4,5.
Зубная эмаль — это прозрачная, тонкая и самая твердая ткань зуба. Она покрывает всю зубную поверхность и играет очень важную защитную роль. Поэтому её называют «минеральным колпачком».
На 97% зубная эмаль состоит из минеральных веществ, из которых 35% составляет кальций и 17% фосфор. Процентное соотношение минеральных веществ в эмали зависит от возраста человека и от условий внешней среды (наличия микроэлементов в пище и воде).
Повреждения зубной эмали ведут неизбежно к кариесу и дальнейшему разрушению зуба.
Эмаль - это бессосудистая и самая твердая ткань организма. Кроме того, эмаль остается относительно неизменной в течение всей жизни человека. Указанные свойства объясняются функцией, которую она выполняет — защищает дентин и пульпу от внешних механических, химических и температурных раздражителей. Только благодаря этому зубы выполняют свое назначение — откусывают и измельчают пищу. Структурные особенности эмали приобретены в процессе филогенеза. Явление проницаемости эмали зуба осуществляется благодаря смыванию зуба (эмали) снаружи ротовой жидкостью, а со стороны пульпы — тканевой и наличию пространств в эмали, заполненных жидкостью. Возможность проникновения в эмаль воды и некоторых ионов известна с конца прошлого и начала нашего столетия. Так, стало известно, что зубная лимфа может проходить через эмаль, нейтрализуя молочную кислоту и постепенно увеличивая плотность за счет содержащихся в ней минеральных солей.
Эмалево-дентинное соединение образовано мембраной, которая на ранних стадиях представлена некальцифицированными коллагеновыми волокнами, отделяющими эмаль от дентина (рис. 18,а). В дальнейшем она минерализуется и является местом соединения кристаллов эмали и дентина (рис. 18,б). Группы призм эмали, как и волокнистые структуры, из одной ткани глубоко вдаются в другую, придавая эмалево-дентинному соединению чашеобразный вид.
Органические вещества эмали
Доля орг.в-в 1 – 1,5%. В незрелой эмали до 20%. Орг.в-ва эмали влияют на биохимические и физические процессы, происходящие в эмали зуба. Орг.в-ва нах-ся между кристаллами апатита в виде пучков, пластинок или спирали. Осн.представители – белки, углеводы, липиды, азотсодержащие в-ва (мочевина, пептиды, цикл.АМФ, цикл.аминокислоты).
Белки и углеводы входят в состав органич.матрицы. Все процессы реминерализации происходят на основе белковой матрицы. Большая часть представлена коллагеновыми белками. Они обладают способностью инициировать реминерализацию.
1. а) белки эмали – нерастворимы в кислотах, 0,9% ЭДТА. Они относятся к коллаген- и керамидо- подобным белкам с большим количеством сер, оксипролина, гли, лиз. Эти белки играют защитную ф-цию в процессе деминерализации. Не случайно в очаге деминерализации на ст.белого или пигментированного пятна кол-во этих белков > в 4 раза. Поэтому кариозное пятно в течение нескольних лет не превращается в кариозную полость, а иногда вообще не развивается кариес. У пожилых людей к кариесу > резистентность. б) кальцийсвязывающие белки эмали. КСБЭ. Содержат ионы Са в нейтральной и слабощелочной среде и способствуют проникновению Са из слюны в зуб и обратно. На долю белков А и Б приходится 0,9% от общей массы эмали.
2. Б.растворимые в воде не связанные с минеральными в-вами. Они не обладают сродством к минер.компонентам эмали, не могут образовывать комплексы. Таких белков 0,3%.
3. Своб.пептиды и отд.аминокислоты, такие как промин, гли, вал, оксипролин, сер. До 0,1%
1) ф-я защитная. Белки окружают кристалл. Предупреждают процесс деминерализации
2) белки инициируют минерализацию. Активно участвуют в этом процессе
3) обеспечивают минер.обмен в эмали и др.твердых тканях зуба.
Углеводы представлены полисахаридами: глюкоза, галактоза, фруктоза, гликоген. Дисахариды нах-ся в свободной форме, а образуются белковые комплексы – фосфо-гликопротеиды.
Липидов очень мало. Представлены в виде гликофосфолипидов. При образовании матрицы они выполняют роль связующих мостиков между белками и минералами.
6.После прорезывания образованная из остатков погибших уплощенных наружных клеток эмалевого органа тонкая пленка – кутикула на жевательных поверхностях стирается. Зрелая эмаль инертна, не содержит клеток и поэтому неспособна к регенерации при повреждениях. Однако имеет место минимальный обмен ионами между эмалью и слюной, благодаря чему на поверхности эмали может происходить минимальное дополнительное обызвествление в виде пленки – пелликула. При недостаточно хорошем гигиеническом уходе за зубами на поверхности эмали образуется зубной налет – скопление микроорганизмов, продукты жизнедеятельности которых изменяет местную РН в кислую сторону, что в свою очередь обуславливает вымывание солей кольция, т.е. может стать началом кариеса. При отложении солей в очагах зубного налета образуются зубные камни.
|
Постоянные зубы |
||||
|
Зубы |
Сроки прорезывания |
Сроки формирования корней |
Окончательное «созревание» эмали |
Закладка фолликулов |
|
6 |
5-6 лет |
в 10 лет |
в 1—3 года |
на 5-м месяце внутриутробного развития |
|
1 |
6-8 лет |
в 10 лет |
в 4-5 лет |
на 8-м месяце внутриутробного развития |
|
2 |
8-9 лет |
в 10 лет |
в 4—5 лет |
на 8-м месяце внутриутробного развития |
|
4 |
9-10 лет |
в 12 лет |
в 5—6 лет |
в 2 года |
|
3 |
10-11 лет |
в 13 лет |
в 6—7 лет |
на 8-м месяце внутриутробного развития |
|
5 |
11-12 лет |
в 12 лет |
в 6—7 лет |
в 3 года |
|
7 |
12-13 лет |
в 15 лет |
в 7—8 лет |
в 3 года |
Главный компонент органических веществ зубной ткани - коллаген I типа. Углеводы и липиды присутствуют в небольших количествах. Содержание органических веществ в твёрдых частях зуба варьирует от 2% (эмаль) до 30% (дентин и цемент). Содержание органических веществ в мягких частях зуба такое же, как в соответствующих видах соединительной ткани.
В настоящее время проницаемость эмали изучена довольно подробно, что позволило пересмотреть ряд ранее существовавших представлений. Если ранее считали, что вещества в эмаль поступают по пути пульпа — дентин — эмаль, то в настоящее время не только установлена возможность поступления веществ в эмаль из слюны, но и доказано, что этот путь является основным. Эмаль проницаема в обоих направлениях: от поверхности эмали к дентину и пульпе и от пульпы к дентину и поверхности эмали. На этом основании эмаль зуба считают полупроницаемой мембраной. Проницаемость — главный фактор созревания эмали зубов после прорезывания. В зубе проявляются обычные законы диффузии. При этом вода (эмалевая жидкость) проходит со стороны малой молекулярной концентрации в сторону высокой, а молекулы и диссоциированные ионы — со стороны высокой концентрации в сторону низкой. Иначе говоря, ионы кальция перемещаются из слюны, которая пересыщена ими, в эмалевую жидкость, где их концентрация низкая. В настоящее время имеются бесспорные доказательства проникновения в эмаль и дентин зуба из слюны многих неорганических и органических веществ. Показано, что при нинесении на поверхность интактной эмали раствора радиоактивного кальция он уже через 20 мин обнаруживался в поверхностном слое. При более длительном контакте раствора с зубом радиоактивный кальций проникал на всю глубину эмали до эмалево-дентинного соединения.
Аналогичными исследованиями установлено включение радиоактивного фосфора в дентин и эмаль интактного зуба животного после внутри-ионного введения или аппликации раствора Na2HP32O4 на поверхность зуба.
В настоящее время установлено, что в эмаль зуба из слюны проникают многие неорганические ионы, причем некоторые и.ч них обладают высокой степенью проникновения. Так, при нанесении раствора радиоактивного йодида калия на поверхность интактных клыков кошки он через 2 ч был обнаружен в щитовидной железе. Длительное время считалось, что органические вещества не проникают в эмаль зуба. Однако при помощи радиоактивных изотопов было установлено внедрение в эмаль, и даже дентин, аминокислот, витаминов, токсинов через 2 ч после нанесения их на неповрежденную поверхность зубов собаки. В настоящее время изучены некоторые закономерности этого важного для эмали явления. Установлено, что уровень ее проницаемости может изменяться под воздействием ряда факторов. Так, этот показатель снижается с возрастом. Электрофорез, ультразвуковые волны, низкое значение рН усиливают проницаемость эмали. Она увеличивается также под воздействием фермента гиалуронидазы, количество которой в полости рта увеличивается при наличии микроорганизмов, зубного налета. Еще более выраженное изменение проницаемости эмали наблюдается, если к зубному налету имеет доступ сахароза. В значительной мере степень поступления ионов в эмаль зависит от их характеристик. Одновалентные ионы обладают большей проникающей способностью, чем двухвалентные. Важное значение имеют заряд иона, рН среды, активность ферментов и др. Особого внимания заслуживает изучение распространения в эмали ионов фтора. При аппликации раствора фторида натрия ионы фтора быстро поступают на небольшую глубину (несколько десятков микрометров) и, как считают некоторые авторы, включаются в кристаллическую решетку эмали. Следует отметить, что после обработки поверхности эмали раствором фторида натрия ее проницаемость резко снижается. Этот фактор имеет важное значение для клинической практики, так как определяет последовательность обработки зуба в процессе реминерализующей терапии.
Такое выражение широко распространено в зарубежной литературе и меньше — в нашей. Под созреванием подразумевается увеличение содержания кальция, фосфора, фтора и других компонентов и совершенствование структуры эмали зуба. Поводом для изучения этого вопроса послужили многочисленные наблюдения изменения зубов и, особенно, эмали после их прорезывания. Так, например, установлено, что у пожилых людей зубы более устойчивы к действию деминерализующих растворов. Это можно объяснить тем, что минеральный состав и структура эмали и дентина с возрастом меняются. Ранее считалось, что изменение химического состава зависит от поступления веществ через пульпу. Однако, по последним данным, изменение минерального состава эмали обусловлено поступлением в нее различных веществ из слюны. В настоящее время установлено, что в эмали после прорезывания зуба происходит накопление кальция и фосфора, наиболее активно — в первый год после прорезывания зуба, когда кальций и фосфор адсорбируются во всех слоях различных зон эмали. В дальнейшем накопление фосфора, а после 3-летнего возраста — кальция, резко замедляется. По мере созревания эмали и увеличения содержания минеральных компонентов растворимость поверхностного слоя эмали, по показателям выхода в биоптат кальция и фосфора, снижается. Установлена обратная зависимость между содержанием кальция и фосфора в эмали и степенью поражения кариесом. Поверхность зуба, где эмаль содержит больше кальция и фосфора, значительно реже поражается кариесом, чем поверхность зуба, эмаль которого содержит меньшее количество этих веществ. В созревании эмали важная роль принадлежит фтору, количество которого после прорезывания зуба постепенно увеличивается. Добавочное введение фтора снижает растворимость эмали и повышает ее твердость. Из других микроэлементов, влияющих на созревание эмали, следует указать на ванадий, молибден, стронций. Механизм созревания эмали изучен недостаточно. Считают, что при этом происходят изменения в кристалличгской решетке, уменьшается объем микропространств в вмали, что приводит к увеличению ее плотности. Данные о созревании эмали имеют важное значение в профилак тике кариеса, так как по ним можно определить оптимальные сроки проведения обработки реминерализующими препаратами. При недостатке фтора в питьевой воде именно в период созревания эмали необходимо дополнительное введение фтора как внутрь, так и местно, что может быть осуществлено полосканием фторсодержащими растворами, чисткой зубов фторсодержащими пастами и другими способами.
Растворимость эмали — одно из важных, присущих этой самой минерализованной ткани человеческого организма свойств. В нормальных естественных условиях полости рта растворимость эмали проявляется лишь в незначительной степени, так как основное качество эмали как биологической ткани — устойчивость ее к постоянному действию различных факторов. Находясь на границе соприкосновения с внешней средой, эмаль все время подвергается сильному воздействию разнообразных факторов: микрофлоры, колебанию температуры, химических веществ, механической нагрузки и др. Сохранение ее свойств и структуры возможно лишь в условиях поддержания постоянного динамического равновесия эмали со слюной в результате физико-химического обмена ее компонентов с этой биологической жидкостью.
7.Взаимосвязь обменов жиров и углеводов:
-
образуемые в пентозофосфатном пути молекулы НАДФН используются для синтеза жирных кислот и холестерола,
-
глицерол-3-фосфат, образуемый из диоксиацетонфосфата гликолиза, направляется для синтеза триацилглицеролов. Также для этой цели может быть использован глицеральдегид-3-фосфат, синтезированный в этапе структурных перестроек пентозофосфатного пути,
-
"глюкозный" и "аминокислотный" ацетил-SКоА способен участвовать в синтезе жирных кислот и холестерола.
Схема превращения глюкозы в жиры
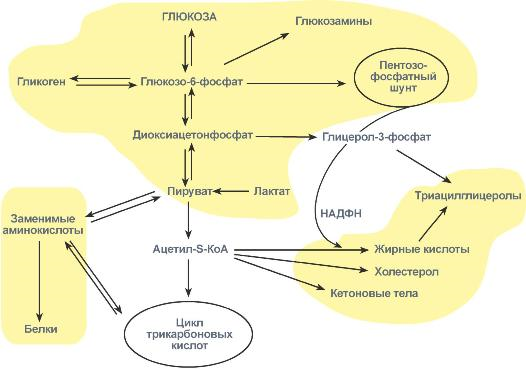
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
Влияние инсулина, глюкагона и адреналина на обмен жиров и углеводов.
Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза)
Адреналин — катаболический гормон и влияет практически на все виды обмена веществ. Под его влиянием происходит повышение содержания глюкозы в крови и усиление тканевого обмена. Будучи контринсулярным гормоном и воздействуя на β2 адренорецепторы тканей и печени, адреналин усиливает глюконеогенез и гликогенолиз, тормозит синтез гликогена в печени и скелетных мышцах, усиливает захват и утилизацию глюкозы тканями, повышая активность гликолитических ферментов. Также адреналин усиливает липолиз (распад жиров) и тормозит синтез жиров
Роль пентозофосфатного пути обмена глюкозы для синтеза жиров
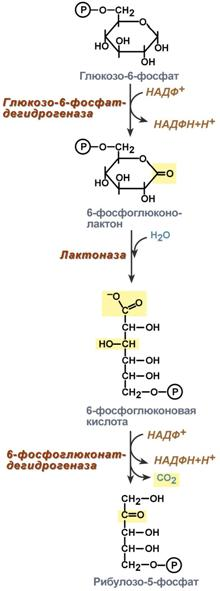
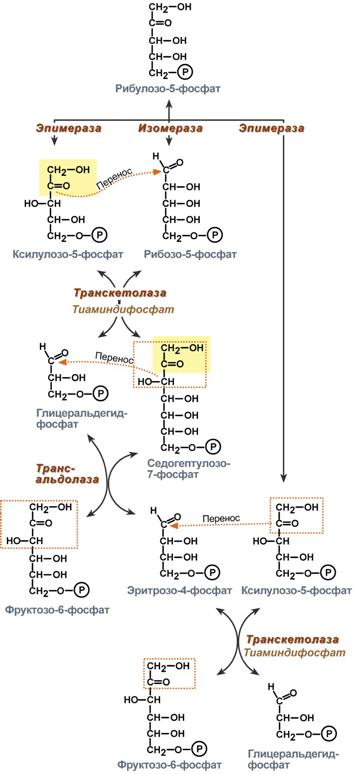
Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо "проваливаться" во 2-й этап гликолиза либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направлятьяся в синтез триацилглицеролов.
Зависимость скорости биосинтеза жиров от ритма питания и состава пищи
После приема пищи концентрация хиломикронов в крови повышается, достигает максимума примерно через 5 ч, затем начинает снижаться.
Если во время приема пищи в печень поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды
Регуляция обмена жиров тесно сопряжена с регуляцией обмена глюкозы. Как и в случае обмена глюкозы, в регуляции обмена жиров важную роль играют гормоны инсулин, глюкагон, адреналин и процессы переключения фосфорилирования-дефосфори-лирования белков. Напомним, что в печени после приема пищи ускоряется аэробный гликолиз и образование ацетил-КоА и оксалоацетата, а из них — цитрата (рис. 10.22; см. также рис. 10.5). Повышение концентрации цитрата активирует цикл переноса ацетильных остатков в цитозоль. В цитозоле в результате активации ацетил-КоА-карбоксилазы путем дефосфорилирования (см. рис. 10.10) ускоряется синтез жирных кислот. Одновременно стимулируется образование НАДФН в результате реакции малат -» пируват, а также в результате активации пентозофосфатного пути (инсулин индуцирует синтез глюкозо-6-фосфатдегидрогеназы). Жирные кислоты и глицерол-3-фосфат, образующийся тоже из глюкозы, превращаются в жиры, которые в печени упаковываются в ЛОНП и секретируются в кровь, а в жировой ткани пополняют запасы жира в адипоцитах. Таким образом в печени и в жировой ткани при пищеварении одновременно активируются гликолиз и синтез жиров из глюкозы. Перенос ацил-КоА в митохондрии не происходит вследствие высокой концентрации малонил-КоА, который ингибирует карни-тин-ацилтрансферазу (см. рис. 10.22); следовательно, не происходит и [3-окис-ление жирных кислот.
Механизмов, способных
осуществлять синтез глюкозы из жирных
кислот, у животных нет, но у растений
такие механизмы имеются.
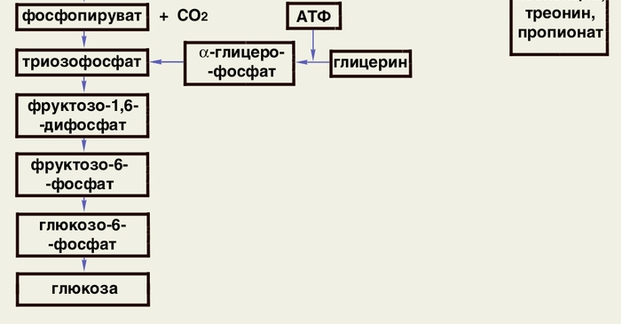
Синтез происходит только из глицерина.
