- •Диаграмма состояния двойных сплавов и методика их построения
- •Лабораторная работа № 2
- •2.2 Задание
- •2.2.5 Ответить на индивидуальный вопрос
- •2.2.6 Составить отчет.
- •2.3 Основные положения
- •Лабораторная работа №3. Диаграмма состояния системы железо-углерод
- •3.2 Задание
- •3.2.4 Ответить на индивидуальный вопрос.
- •3.2.5 Составить отчет.
- •3.3 Основные положения
- •Лабораторная работа №4 микроструктура чугунов
- •4.2 Задание
- •4.2.6 Ответить на индивидуальный вопрос.
- •4.2.7 Составить отчет
- •4.3 Основные положения
- •5.2 Задание
- •5.2.8 Ответить на индивидуальный вопрос.
- •5.2.9 Составить отчет.
- •5.3 Основные положения
- •6.2 Задание
- •6.2.8 Ответить на индивидуальный вопрос
- •6.2.9 Составить отчет.
- •6.3 Основные положения
- •7.2 Задание
- •7.2.4 Ответить на индивидуальный вопрос.
- •7.2.5 Составить отчет.
- •8.2 Задание
- •8.2.9 Составить отчет.
- •8.3 Основные положения
- •Лабораторная работа № 9. Микроструктуры легированных сталей
- •9.2 Задание
- •9.2.4 Ответить на индивидуальный вопрос.
- •9.2.5 Составить отчет.
- •9.3 Общие положения
- •Лабораторная работа №10. Микроструктуры цветных сплавов
- •10.2 Задание
- •10.2.4 Ответить на индивидуальный вопрос.
- •10.2.5 Составить отчет.
- •10.3 Общие положения
- •Лабораторная работа №11. Термическая обработка дюралюминия
- •11.2 Задание
- •11.2.4 Ответить на индивидуальный вопрос.
- •11.2.5 Составить отчет.
- •Лабораторная работа №12. Влияние концентратора напряжения на сопротивление пластмасс при ударном изгибе
- •12.2 Задание
- •12.2.5 Ответить на индивидуальный вопрос.
- •12.2.6 Составить отчет.
- •12.3 Общие положения
- •12.5 Отчет о работе
- •Библиографический список
Оглавление
Введение………………………………………………………………….4
1 Лабораторная работа № 1…………………………………………...…5
2 Лабораторная работа № 2………………………………………….....13
3 Лабораторная работа № 3………………………………………….....20
4 Лабораторная работа № 4………………………………………….....32
5 Лабораторная работа № 5………………………………………….....45
6 Лабораторная работа № 6………………………………………….....56
7 Лабораторная работа № 7………………………………………….....64
8 Лабораторная работа № 8………………………………………….....77
9 Лабораторная работа № 9………………………………………….....87
10 Лабораторная работа № 10……………………………………….....96
11 Лабораторная работа № 11………………………………………...105
12 Лабораторная работа № 12………………………………………...112
Библиографический список………………………………………….120
Введение
Дисциплина «Материаловедение» присутствует во всех учебных планах инженерных специальностей Муромского института (филиала) ВлГУ для студентов дневной, вечерней и заочной форм обучения. Для инженерных специальностей машиностроительного профиля предусматриваются лекционные занятия, 34 часа лабораторных работ и экзамен. Эта дисциплина изучается в 4-5 семестре параллельно «Сопротивлению материалов», «Технологическим процессам машиностроительного производства» и предшествует «Деталям машин и основам конструирования». Такое положение «Материаловедения» по отношению к другим общепрофессиональным дисциплинам позволяет создать у студентов целостные знания о свойствах материалов и методов управления этими свойствами, что будет использовано в дальнейшем при конструировании и расчетах деталей машин.
Знания по материаловедению являются одними из важнейших в системе инженерной подготовки студентов машиностроительных специальностей. Кроме теоретических знаний необходимо выработать у студентов умения и навыки проведения экспериментальных исследований, измерений параметров, наблюдений и анализа. Эти требования обеспечиваются выполнением лабораторных работ, количество и содержание которых соответствует учебному плану и программе. По каждой лабораторной работе предусматривается предварительное изучение студентом определенного теоретического материала и знание ответов на вопросы для самопроверки. После выполнения лабораторной работы и оформления отчета студент защищает полученные результаты. В результате у него вырабатываются практические умения и знания по основным разделам материаловедения, что способствует успешной подготовке к экзаменам.
Лабораторная работа № 1
Диаграмма состояния двойных сплавов и методика их построения
1.1 Цель работы: освоить методику построения диаграмм состояния двойных сплавов, научиться определять фазы и структуры в сплавах при различных температурах, их количественное соотношение и химический состав.
1.2 Задание
1.2.1 Используя литературные источники [1] изучить строение сплавов и типовые диаграммы двойных сплавов.
1.2.2 Ознакомиться с правилом фаз и правилом отрезков.
1.2.3 Для ряда сплавов свинца с оловом построить кривые охлаждения с помощью потенциометра ЭПП-09, включенного в опытную установку (рис. 1.1.) и определить критические точки.
1.2.4 Пользуясь правилом фаз, провести анализ кривых охлаждения сплавов, по экспериментальным данным вычертить кривые охлаждения в координатах температура – время. Полученные результаты анализа занести в таблицу 1.1.
1.2.5 Используя данные таблицы 1.1. построить диаграмму состояния свинец – олово в координатах температура – состав сплава. Во всех областях диаграммы состояния обозначить образующиеся структуры.
1.2.6 Для заданного сплава проанализировать формирование структур с изменением температуры. Пользуясь правилом отрезков, определить при заданной температуре количественные соотношения фаз и химический состав, результаты занести в таблицу 1.2.
1.2.7 Ответить на индивидуальный вопрос.
1.2.8 Составить отчет.
1.3 Основные положения
Эксплуатационные и технологические свойства сплавов зависят от их структуры при различных температурах. Изменение структуры сплавов в условиях равновесия в зависимости от температуры и концентрации компонентов показывает диаграмма состояния. Диаграмма состояния позволяет определить температуры начала и конца кристаллизации, температуру фазовых превращений в твердом состоянии, структуру сплава при заданной температуре и концентрации компонентов.
Наиболее распространенными диаграммами металлических сплавов являются:
-
диаграмма состояния сплавов, образующих в твердом виде механические смеси чистых компонентов;
-
диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью компонентов;
-
диаграмма состояния сплавов с ограниченной растворимостью компонентов и с эвтектикой;
-
диаграмма состояния сплавов с образованием химических соединений.
Существует несколько методов построения диаграмм состояния. Наиболее простым, удобным и достаточно точным является термический метод. Сущность этого метода заключается в следующем: экспериментально получают кривые охлаждения сплавов в координатах температура –время и по остановкам и перегибам на этих кривых, вызванных тепловым эффектом превращений, определяют температуры превращения. Эти температуры называют критическими точками.
Анализ кривых охлаждения и диаграмм состояния определяется правилом фаз. Правило фаз устанавливает зависимость между числом степеней свободы (с), числом компонентов (к) и числом фаз, находящихся в равновесии (ф). Для металлических систем правило фаз выражается уравнением:
![]() (1.1)
(1.1)
где 1 – число внешних факторов (температура).
Так
как число степеней свободы не может
быть меньше нуля и не может быть дробным
числом, то
![]() ,
т.е. число фаз в сплаве, находящемся в
равновесном состоянии, не может быть
больше, чем число компонентов, плюс
единица.
,
т.е. число фаз в сплаве, находящемся в
равновесном состоянии, не может быть
больше, чем число компонентов, плюс
единица.
Если С = 0, то такое равновесие называют нонвариантным (безвариантным). При таком равновесии сплав из данного числа фаз может существовать только в совершенно определенных условиях: при постоянной температуре и определенном составе фаз. Это означает, что превращение начинается и заканчивается при постоянной температуре.
Если С=1, то такое равновесие называется моновариантным. В этом случае возможно изменение одного из факторов (температура) и это не вызывает изменения числа фаз.
Если С=2, то такое равновесие называют бивариантным (двухвариантным), в этом случае возможно изменение двух факторов (температура и концентрация) без изменения числа компонентов и фаз системы
1.4 Порядок выполнения работы
1.4.1 Бригада студентов из 2-3 человек, пользуясь опытной установкой (рис.1.1), строит кривую охлаждения для заданного сплава (таблица 1.1) системы свинец-олово (рис.1.2а).
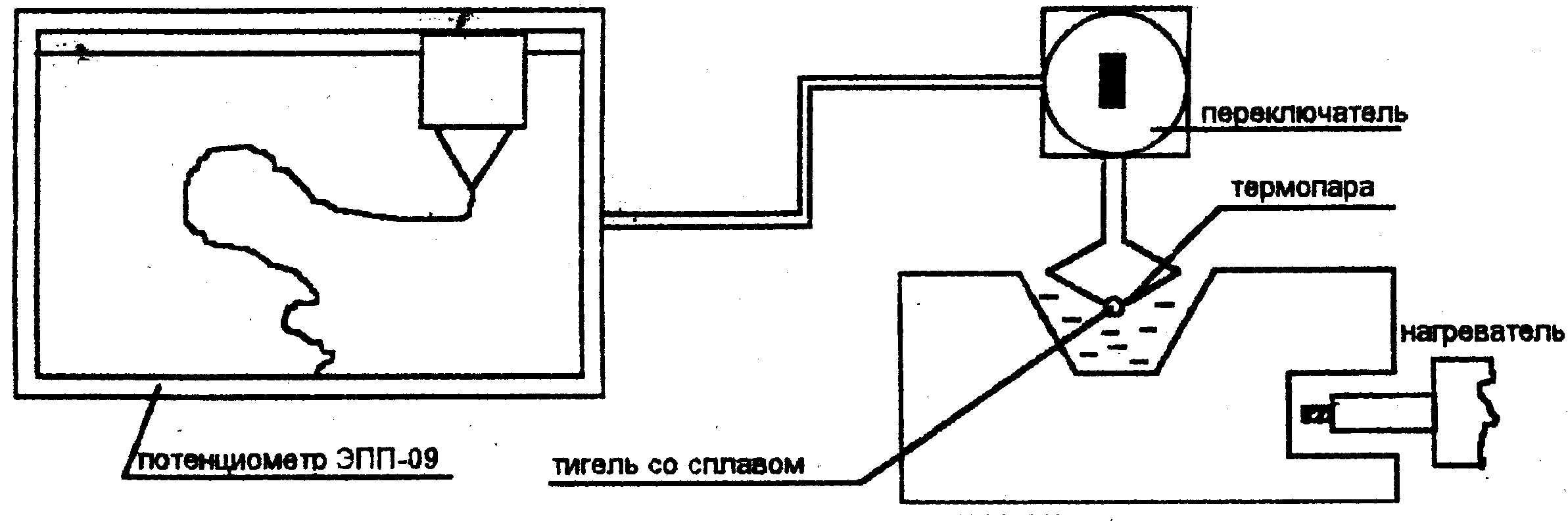
Рис.1.1. Схема опытной установки для записи
кривых охлаждения сплавов.
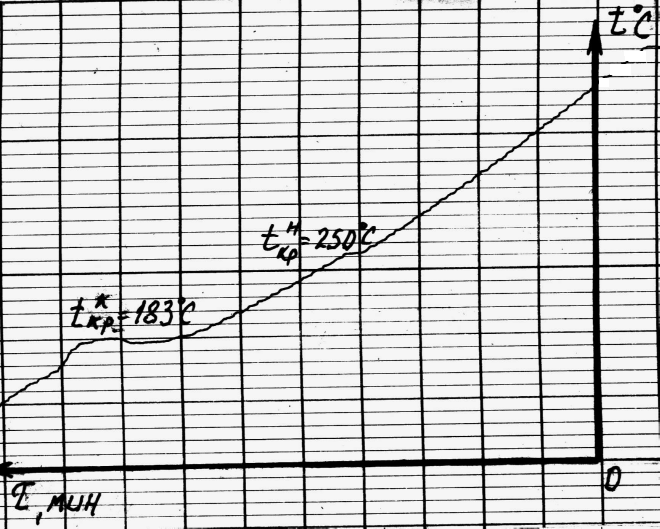
1.4.2. По перегибам на кривой охлаждения сплава (Рис.1.2а) определяют критические точки - температуру начала и конца кристаллизации.
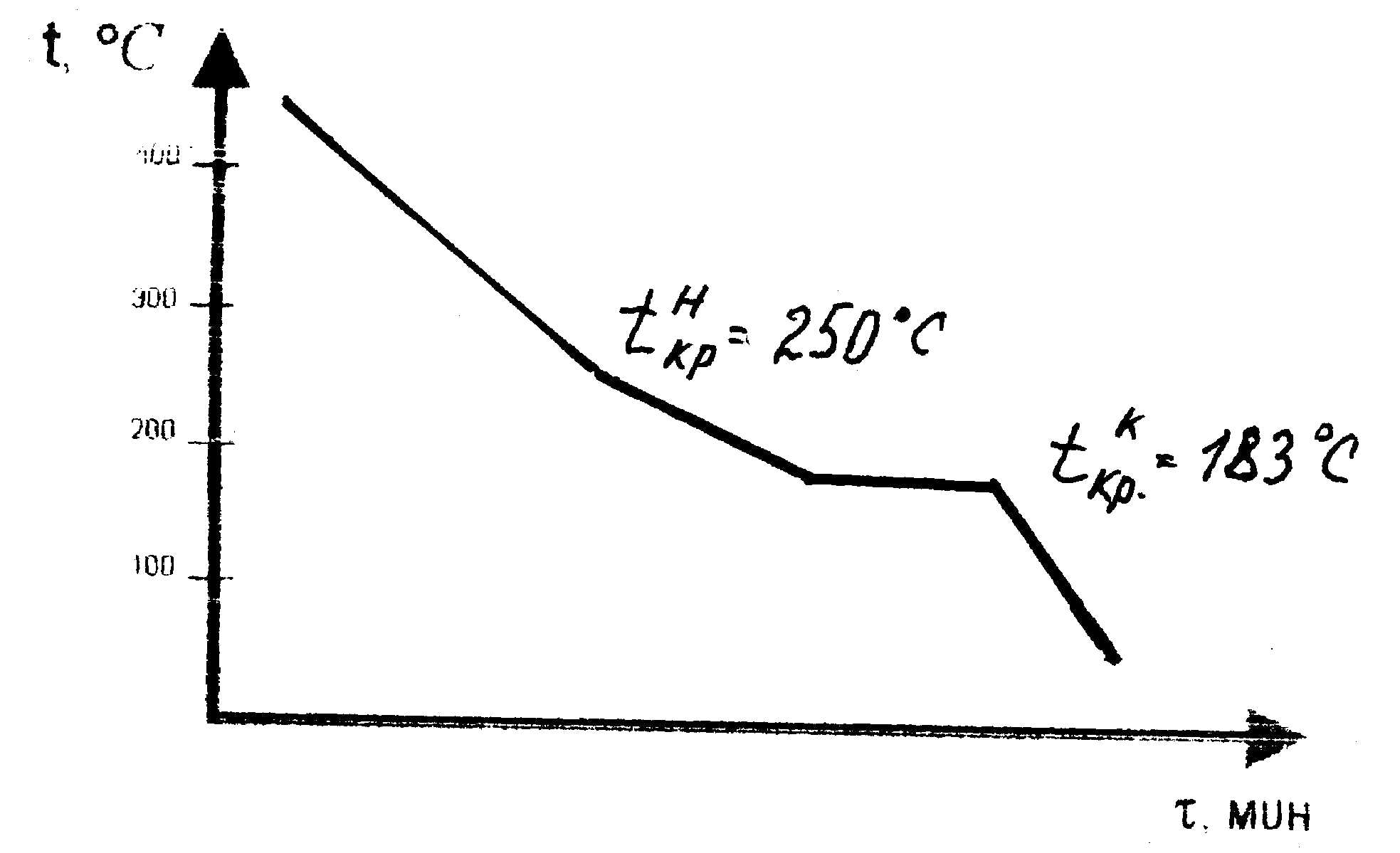
1.4.3. Пользуясь правилом фаз, проверяют правильность построения кривой охлаждения и строят ее в масштабе в координатах температура- время (рис. 1.2б).
|
|
|
|
Рис. 1.2,а. Кривая охлаждения сплава №4 (65% Pb, 35% Sn) построенная потенциометром ЭПП - 09
|
Рис. 1.2,б. Кривая охлаждения сплава №4 (65% Pb, 35% Sn), построенная по экспериментальным данным |
Полученные результаты заносят в таблицу 1.1.
Таблица 1.1
Результаты исследований
|
№ п/п |
Состав сплава, % |
Температура в критических точках, 0С |
||
|
Свинец |
Олово |
Верхняя |
Нижняя |
|
|
1 |
2 |
3 |
4 |
5 |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
1.4.4 По данным таблицы 1.1 каждый студент строит диаграмму состояния свинец-олово (рис.1.3) в координатах температура-концентрация компонентов и обозначают во всех областях образующиеся структуры.
1.4.5 Для заданного сплава, например, сплав №4 (65% Pb, 35% Sn), пользуясь правилом отрезков (рычага), определяют количественное соотношение фаз и химический состав каждой фазы.
Для этой цели через заданную точку (точка с) на диаграмме (рис.1.3), соответствующую сплаву заданного состава и при определенной температуре, проводят линию, горизонтальную оси концентрации до пересечения с линией ликвидус (точка а) и солидус (точка в). Эта линия называется канодой.
Для определения количества жидкой фазы пользуются соотношением:
![]() (1.2.)
(1.2.)
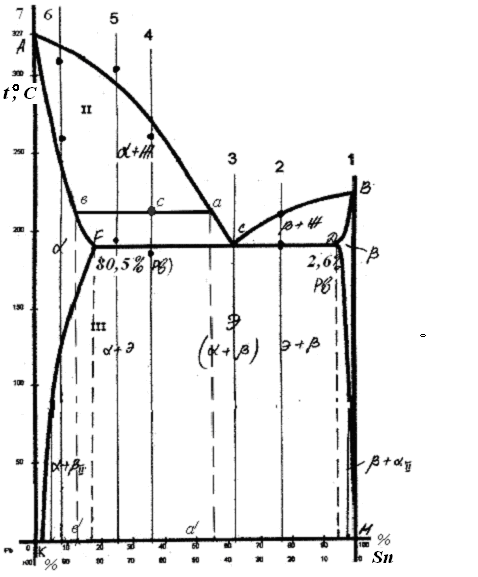
Рис.1.3. Диаграмма состояния Pb - Sn
Для определения количества твердых кристаллов пользуются соотношением:
![]() (1.3)
(1.3)
Для определения химического состава каждой фазы из точек пересечения каноды с линиями ливидус и солидус проводят линии перпендикулярные оси концентрации до пересечения с ней.
Проекции точек а и в на ось концентрации (а' и б') разделяют ее в пропорциях, соответствующих химическому составу фаз, точка а' определяет концентрацию жидкой фазы, а точка б' – твердой.
Результаты анализа кривой кристаллизации и расчетов заносят в таблицу 1.2.
Таблица 1.2
|
№ п/п |
Хим. состав сплава |
Период |
Название периода |
Количество фаз |
Количество степеней свободы |
Химический состав фаз и количественное соотношение фаз при t0C |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
|
|
|
1.5 Отчет о работе
1.5.1 Название, цель работы и задание.
1.5.2 Порядок выполнения работы. Схема опытной установки (рис.1.1.).
1.5.3 Графики кривых охлаждения заданного сплава, построенных с помощью потенциометра эпп-09 (рис.1.2а), по опытным данным (рис. 1.2б).
1.5.4 Таблица критических точек сплавов разного состава (таблица 1.1.).
1.5.5 Таблица результатов анализа кривой охлаждения сплава заданного состава (таблица 1.2.).
1.5.6 Диаграмма состояния сплава свинец – олово (рис.1.3.).
1.5.7 Ответ на индивидуальный вопрос.
1.6 Контрольные вопросы
1. Основные типы диаграмм состояния двойных сплавов?
2. Что такое фаза, компонент, система?
3. Правило фаз.
4. Особенности кристаллизации чистых металлов.
5. Что такое критическая температура?
6. Что такое эвтектическое и эвтектоидное превращения?
7. Твердые растворы, химические соединения, механическая смесь.
8. Сущность построения диаграмм состояния двойных сплавов.
9. Правило отрезков.
10. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии.
11. Как определить химический состав (концентрацию) фаз, находящихся в равновесии в двухфазной области?
12. Связь между свойствами сплавов и типом диаграммы состояния (закон Курнакова).