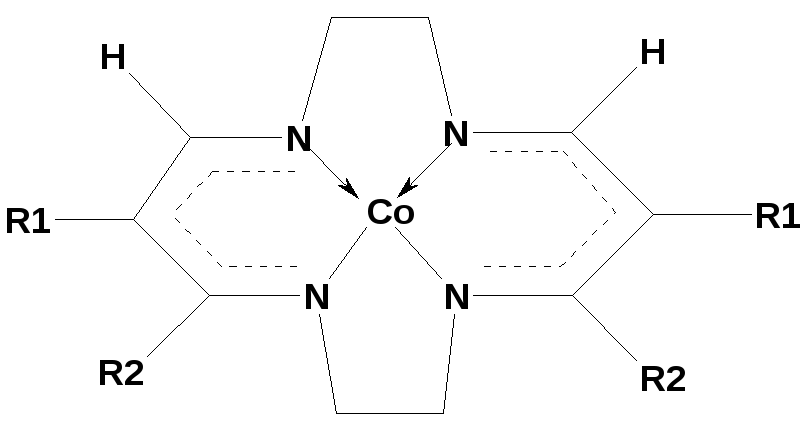
Додаткова надтонка структура
Якщо ліганди координовані до іону металу через атоми, які мають ненульовий ядерний спін (N, P, F, Cl, Br,), то в спектрах ЕПР можна також спостерігати додаткову надтонку структуру (ДНТС) від ядер лігандів, яка виникає за рахунок взаємодії спіна неспареного електрона метала з ядерним спіном донорного атому, що є свідченням делокалізації електронів металу в комплексі. Це свого часу був перший прямий експериментальний доказ ковалентного характеру звязку метал-ліганд. Якщо донорними атомамами є атоми кисню чи сірки, то ДНТС не спостерігається, оскільки спін ядра цих атомів дорівнює нулю.
Число ліній ДНТС визначається за формулою Ni = 2nIi + 1 , де Іi - спін ядра донорного атому, n - кількість донорних атомів даного типу координованих до іону металу. Так, якщо в координаційній сфері купруму(ІІ) міститься два донорних атоми азоту (ІN =1), то в спектрі ЕПР його розчину повинні спостерігатись (221+1)=5 ліній ДНТС.
Відстань між лініями ДНТС в спектрі ЕПР називається константою додаткової надтонкої структури. Константа ДНТС визначається в одиницях поля. Важливою характеристикою спектрів ЕПР є також співвідношеня інтенсивностей ліній в спектрі, яке допомогає проводити їх правильну інтерпретацію (табл. 3). Аналізуючи число ліній у спектрах ЕПР і характер розподілу інтенсивностей ліній, можна визначати склад комплексів і спосіб координації лігандів. Особливо це важливо, коли в системі одночасно утворюються кілька комплексів різного складу.
Таблиця 3. Розподіл інтенсивностей ліній НТС від т еквівалентних ядер із спіном І
|
m |
Відносна інтенсивність |
m |
Відносна інтенсивність |
|
1 2 3 4 5 6
|
І = 1/2 1 1 1 2 1 1 3 3 1 1 4 6 4 1 1 5 10 10 5 1 1 6 15 20 15 6 1
|
1 2 3 4
1 2 3 4
|
І = 1 1 1 1 1 2 3 2 1 1 3 6 7 6 3 1 1 4 10 16 19 16 10 4 1
І =3/2 1 1 1 1 1 2 3 4 3 2 1 1 3 6 10 12 12 10 6 3 1 10 20 31 40 44 40 31 20 10 1 |
Наявність і характер ДНТС в ЕПР спектрах дає досить широкі можливості для дослідження реакцій комплексоутворення в розчинах, а саме: встановлення способу координації лігандів, встановлення кількості комплексів у розчині і їх складу, у деяких випадках метод ЕПР дозволяє встановити утворення комплексів з незвичайним ступенем окиснення металу (табл.1 ) і дослідити їх склад і будову. Нижче наведено кілька прикладів використання ДНТС для дослідження будови координаційних сполук.
При взаємодії MoOCl3 з тіоціанатом амонію у розчинах з концентрацією молібдену 10-3 моль/л було одержано комплекс, в спектрі ЕПР якого спостерігається ДНТС (рис. 12). Тобто центральна інтенсивна лінія спектру ЕПР вихідного комплексу (рис. 11 в) розщепилася на дев′ять ліній зі співвідношенням інтенсивностей 1 : 4 : 10 : 16 : 19 : 16 : 10 : 4 : 1. Наявність ДНТС є прямим доказом перекривання орбіталей іона молібдену з орбіталями атома нітрогену (ІN= 1) тіоціанат іона, оскільки в SCN- групі тільки атом нітрогену має ненульовий спін ядра. Тобто спектр ЕПР комплексу молібдену(V) однозначно вказує, що тіоціанат іон координується до молібдену через атоми нітрогену. Крім того, за кількістю ліній ДНТС можна легко розрахувати склад утвореного у розчині комплексу: 2nI + 1=9, n=4. Отже в розчині утворився комплекс складу MoO(NCS)4lY( Y позаплощинний ліганд.
|
|
Рис. 12. Спектр ЕПР MoO(NCS)3ClYпри 248º К |
|
|
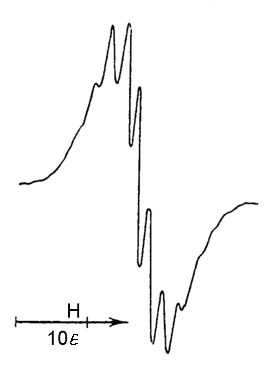
Рис. Спектр ЕПР комплексу нікеля(ІІІ) при 293 оС |
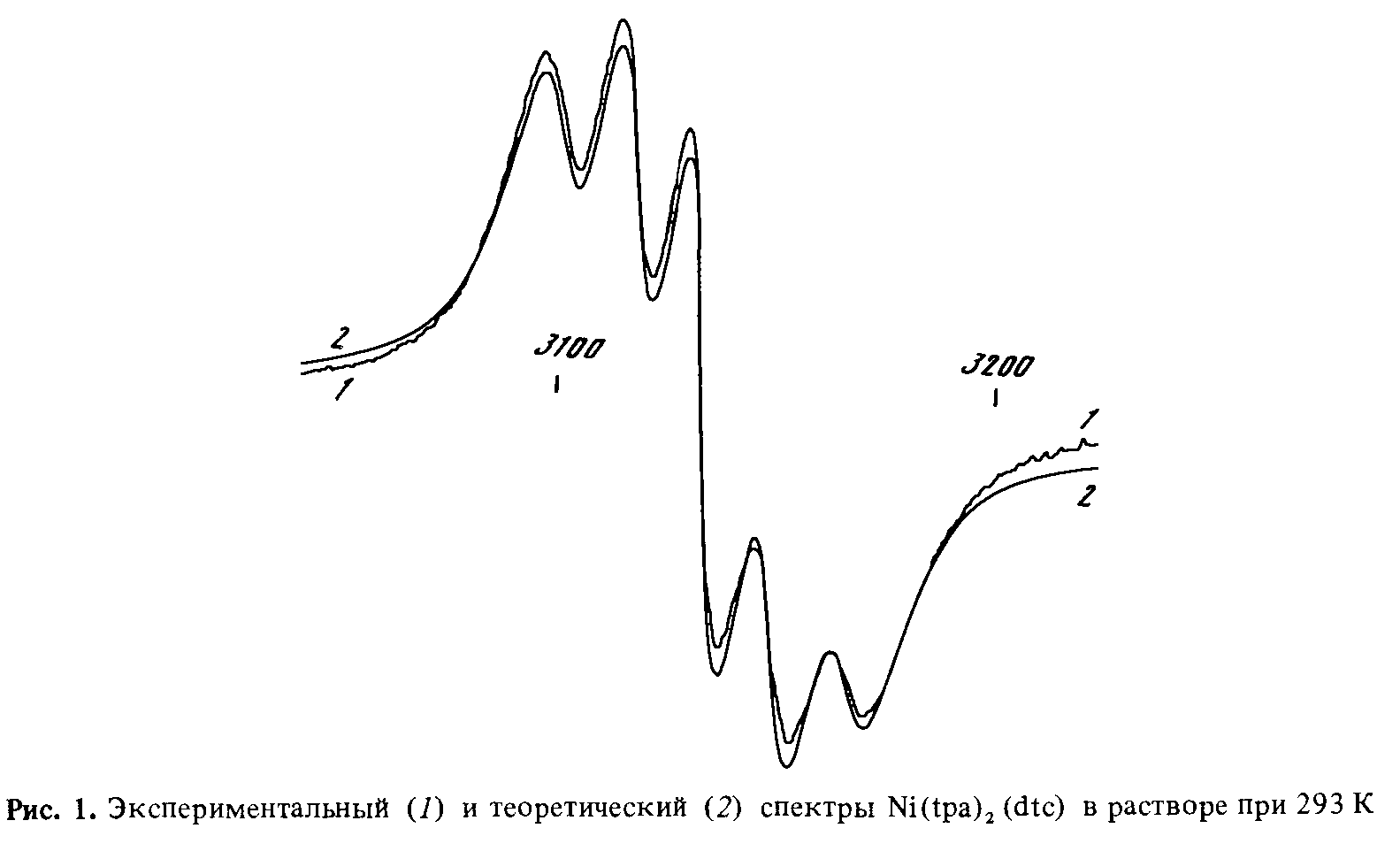
В настоящей работе методом ЭПР исследовано взаимодействие ТЭТД с а-тиопиколинанилидом никеля (II) Ni(tра)2, который также является низкоспиновым плоскоквадратным комплексом никеля (II). Координационная сфера Ni(tpa)2 состоит из двух атомов серы и двух атомов азота с транс-распложением гомоатомов:
Спектр ЭПР Ni(III) при 293 К представляет собой квинтет линий с соотношением интенсивностей 1:2:3:2:1 (рис. 1). Эти пять линий являются дополнительной сверхтонкой структурой (ДСТС) от двух эквивалентных атомов с ядерным спином I = 1. В нашем случае такими атомами могут быть только атомы азота. Спектр описывается изотропным спиновым гамильтонианом (СГ) вида
|
|
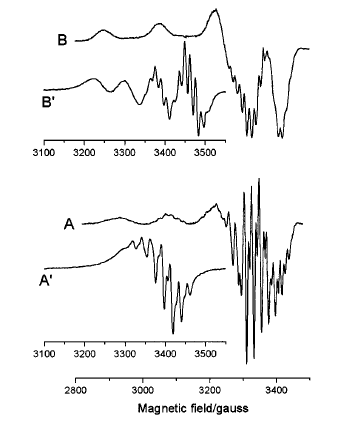
Рис. 8. Спектри
сполук у CH2Cl2
при 77 К
(В) і 293 К
|
На мал.5 зображені типові спектри ЕПР полікристалічних комплексів Cu з різною симетрією
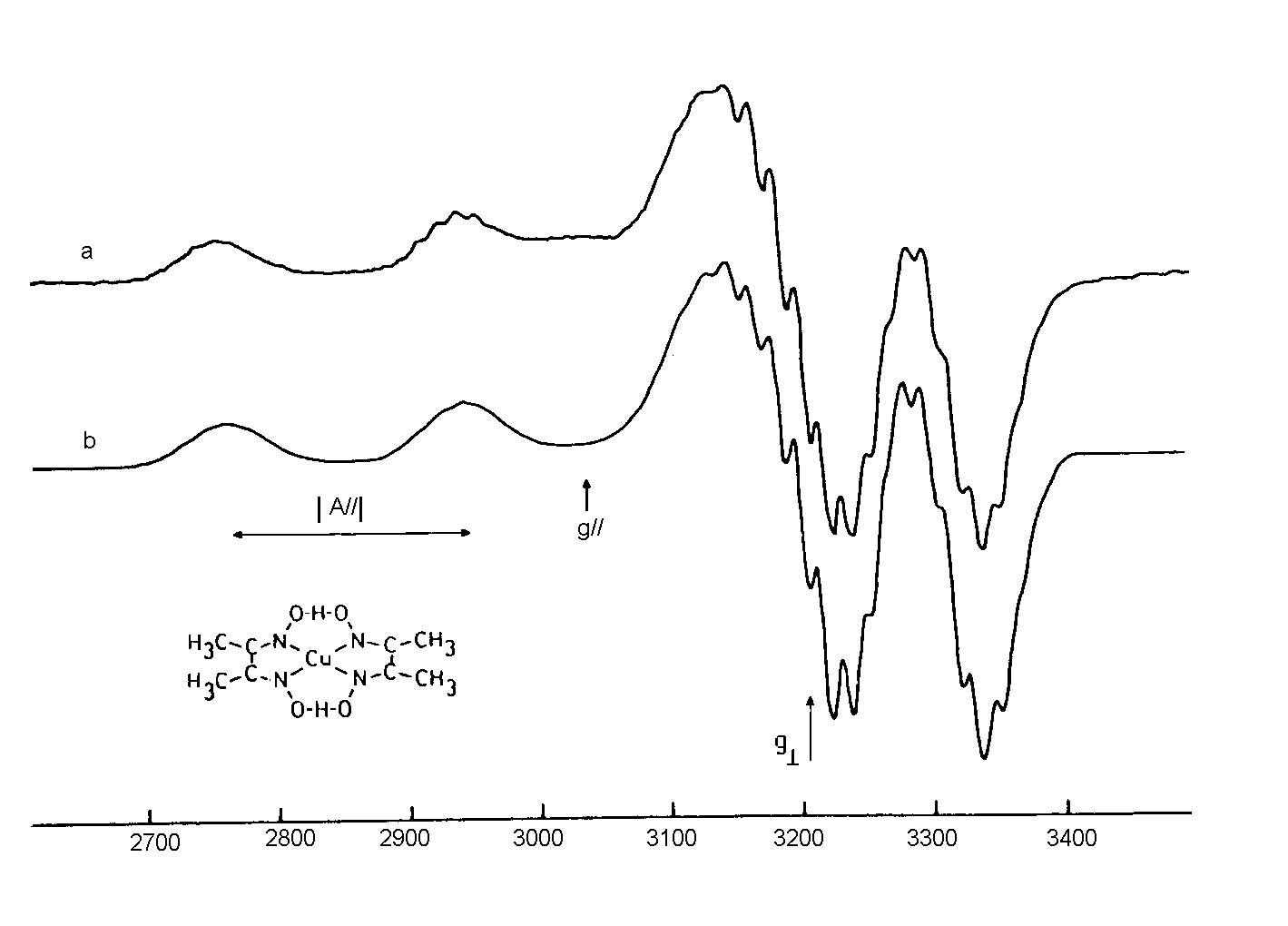
Експериментальний (а) та теоретичний (b) спектри комплексу Cu2+, в яких проявляється надтонка структура, обумовлена взаємодією з атомами нітрогену. Зразок – розчин диметилгліоксимату купруму в хлороформі, що містить 0.2 М піридину.
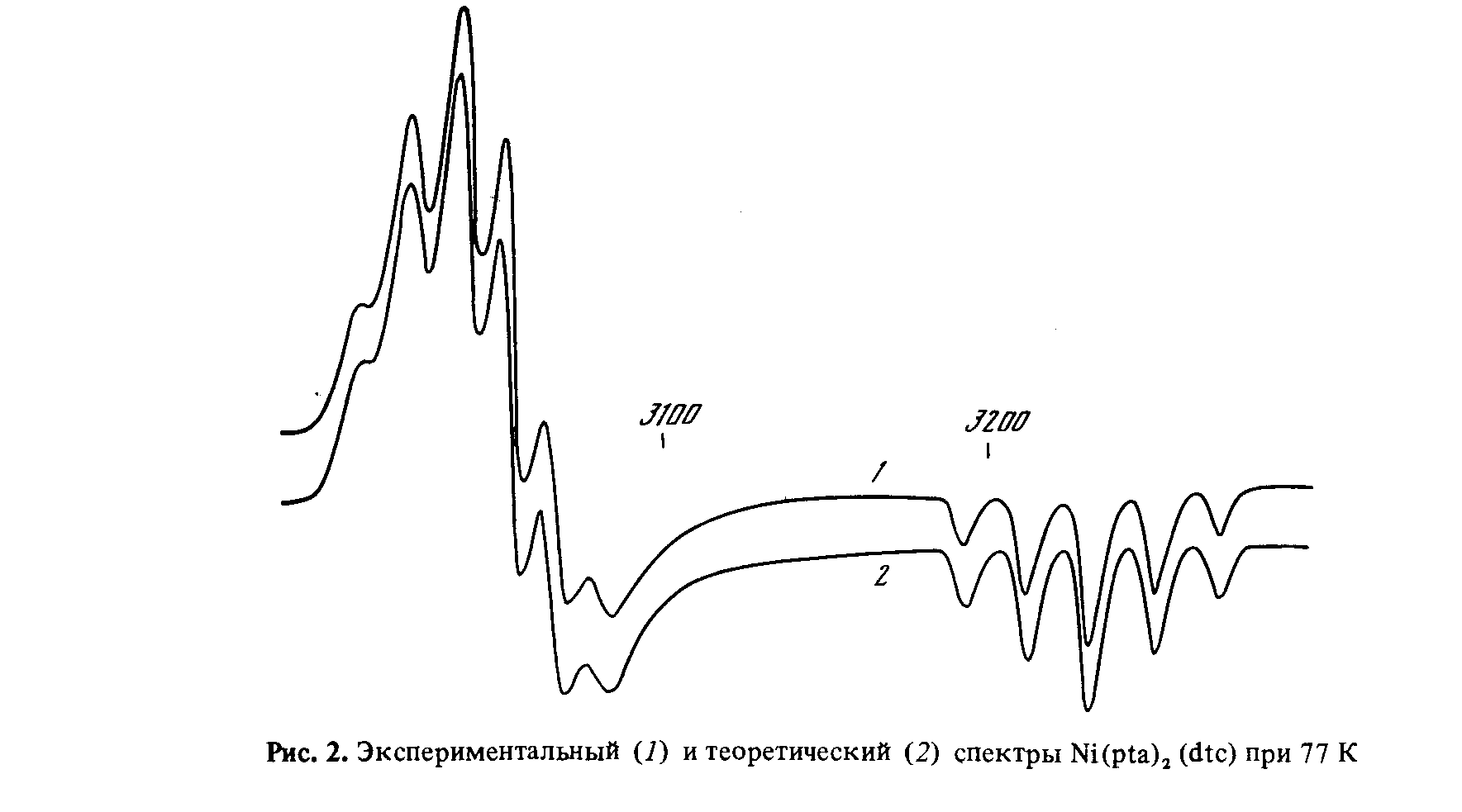
Эксперементальный (1) и (2) теоретический спектры Ni(tpa)2(dtc) в растворе при 77К
|
|
|
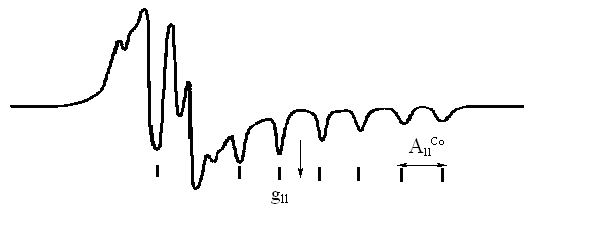
Рис. 1. Спектр ЕПР замороженого спиртового розчину диметилгліоксимату кобальту (ІІ) |
|
|
|
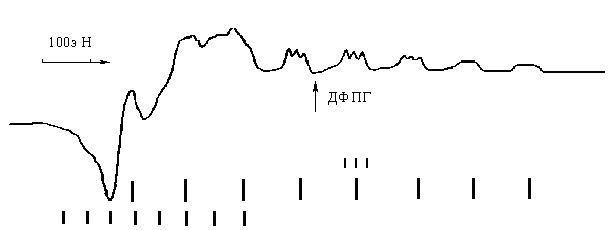
Рис. 3. Спектр ЕПР сполуки ІІ в піридині при 77° К |
II: R1 = COCH3; R2 = CH3;