
Надтонка структура спектрів епр
Якщо центральний атом металу має ядро із відмінним від нуля ядерним спіном І (табл. 2), то в результаті взаємодії між електронним і ядерним спіном, яка носить назву надтонкої взаємодії (НТВ), змінюється енергетичний стан електрона. У відповідності з 2I + 1 можливими проекціями ядерного моменту на напрям магнітного поля, кожний із електронних зеєманівських рівней розщеплюється на 2І + 1 підрівнів. Енергія розщеплення між сусідніми енергетичними рівнями з різним значенням mI називається константою надтонкої взаємодії.
Таблиця 2. Спін ядра і розповсюдженість деяких атомів
|
ізотоп
|
розповс., |
спін ядра, І |
ізотоп |
розповс., |
спін ядра, І |
|
H1 |
99,98 |
1/2 |
Co59 |
100 |
7/2 |
|
N14 |
99,64 |
1 |
Ni |
|
|
|
F19 |
100 |
1/2 |
Cu63,65 |
69,1; 30,9 |
3|2, 3/2 |
|
P31 |
100 |
1/2 |
Ag |
|
1/2 |
|
Ti47 |
7,3 |
5/2 |
Nb93 |
100 |
9/2 |
|
Ti49 |
5,5 |
7/2 |
Mo2n+1 |
75 |
5/2 |
|
V51 |
99,8 |
7/2 |
W183 |
14,3 |
1/2 |
|
Cr53 |
9,6 |
3/2 |
Re185,187 |
37,1; 62,9 |
5/2 |
|
Mn55 |
|
5/2 |
Au197 |
100 |
3/2 |
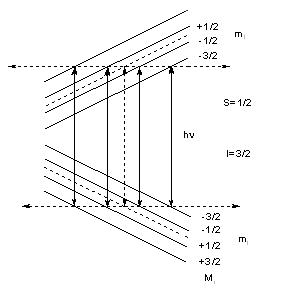
Відносні енергії цих рівнів для атому гідрогену (ІН = ½) показано на рис. 8. Переходи між рівнями ведуть до появи в спектрі ЕПР ліній надтонкої структури (НТС). Оскільки дозволеними є лише переходи з Δms = ±1 i ΔmI =0 (див. рис. 5), то при постійному значенні частоти ν в спектрі ЕПР атому гідрогену з’являться дві лінії НТС, відстань між якими визначається в Гаусах і називається константою надтонкої структури. Константа НТС позначається літерою А (велика) або а ( маленька) і визначається зі спектру як показано на рис. 8. Константа надтонкої взаємодії визначається в см-1, тобто в одиницях енергії і розраховується як gβА, де А – константа НТС, виражена в Гс. Значення напруженості магнітного поля, яке є необхіним для розрахунку g-фактора за формулою (3), знаходять по центру спектра (рис. 8).
Рис. 8. Енергетичні рівні неспареного електрона атома гідрогену в магнітному полі
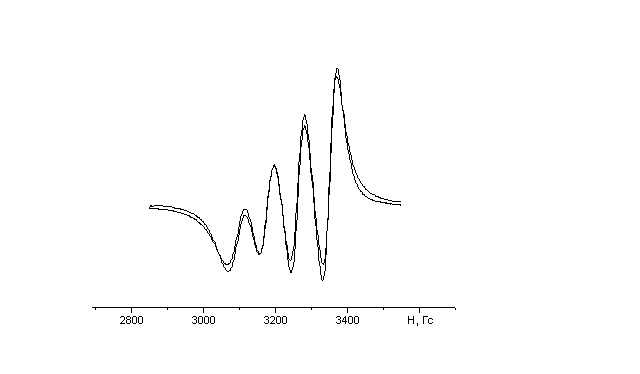
Спін ядра атому купруму дорівнює 3/2, тому енергетичні рівні неспареного електрона купруму(ІІ) у магнітному полі розщеплюються на 2∙3/2+1=4 компоненти (рис.9 а). Тому у спектрі ЕПР сполук купруму(ІІ) повинні спостерігатись чотири лінії НТС, відстань між якими у першому наближенні є однаковою і дорівнює константі НТС. На рис. 9 б зображено типовий для моноядерних комплексів купруму спектр ЕПР комплексу і показано як проводиться розрахунок параметрів спетра.
|
|
|
|
|
|
|
Рис.9. Схема енергетичних рівнів для випадку S =1\2, І = 3\2 |
Рис. 10. Типовий спектр ЕПР комплека купруму(ІІ) в розчині при 293 К і його реконструкція |
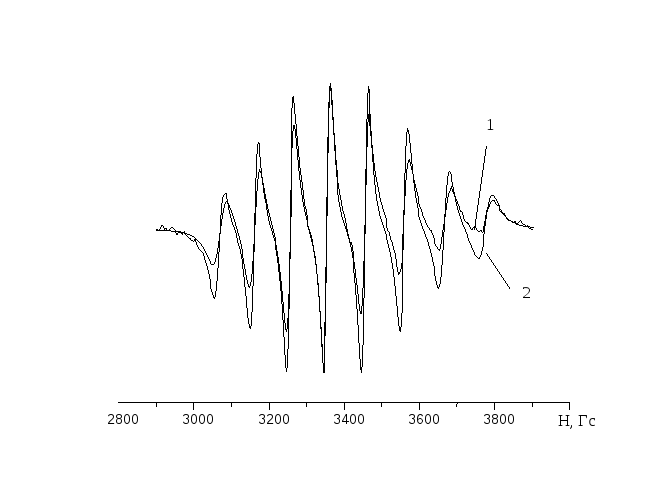
Не всі ядра мають магнітний момент, крім того ядра багатьох металів мають різні значення ядерного спіну, які до того ж іноді відрізняються для різних ізотопів (табл. 2.). У результаті спектри ЕПР розчинів таких металів мають характерну форму, яка в багатьох випадках не тільки полегшує ідентифікацію спектрів, але є чутливим аналітичним методом визначення присутності того чи іншого металу в розчині. Деякі найбільш типові спектри рідких розчинів зображено на рис. 11.
Задача: При розчиненні NbCl5 в піридині при 293К був зареєстрований спектр ЕПР, який складається із 10 ліній. Що можна сказати про склад комплексу, який при цьому утворився?
Розв′язок: Електронна конфігурація Nb+5: 4s24p64d0, тобто він не має неспарених електронів, а значить і ліній поглинання в спектрах ЕПР. З іншого боку спін ядра ніобію ІNb=9/2 і тому в його спектрі ЕПР повинно бути (2І+1)=10 ліній. Таким чином, експериментальний спектр ЕПР обумовлений саме сполуками ніобію. Поява спектру свідчить, що відбулося відновлення ніобію(V) до ніобію(IV), який має електронну конфігурацію 4s24p64d1, тобто має один неспарений електрон. Оскільки для хлоридних комплексів ніобію характерним є координаційне число 6, то можна допустити, що в розчині утворилися комплекси складу NbCl4Py2.
|
|
|
|
|
Рис. 11. Типові спектри ЕПР рідких розчинів комплексів перехідних металів: а -VО(ІІ); б – Ті(ІІІ); в - МоО(ІІІ).
|
Коли в системі утворюються кілька комплексів, то, на відміну від спектрофотометричного, потенціометричного методів, які дозволяють встановити кількість комлексів тільки шляхом математичної обробки кривих властивість – концентрація, тобто непрямим шляхом, метод ЕПР у багатьох випадках дозволяє “бачити” кожний із утворених комплексів, визначати їх параметри і з певною точністю співвідношення концентрацій. Якщо лінії у спектрах ЕПР при кімнатній температурі є достатньо вузькими, то такі дослідження можна проводити і при кімнатній температурі.
На рис. 12 наведено результати ЕПР спектроскопічного дослідження ступінчатого комплексоутворення оксогалогенідних комплексів Mo(V). Методика цього дослідження полягає у вивченні зміни форми спектру ЕПР вихідного комплексу MOCl4Y´ у залежності від співвідношення концентрацій іонів Cl та Br. Були записані спектри ЕПР комплексів Мо(V) у розчинах із постійною концентрацією HCl + HBr та змінним співвідношенням [Cl-]/[Br-]. Зрозуміло, що в розчині HCl спектр належить комплексу MoOCl52-, а в розчині HBr – комплексу МоОBr52-. При різних співвідношеннях [Cl-]/[Br-] у спектрах ЕПР, крім ліній поглинання хлоро- та бромокомплексів, були зареєстровані ще три нові лінії. Можна припустити, що три нові лінії в спектрі ЕПР Мо(V) належать змішанолігандним комплексам, які утворюються за реакціями заміщення:
MoOCl52- + jBr- MoOCl5-jBrj2- + jCl-.
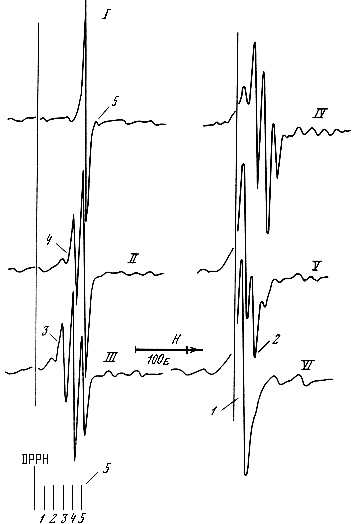
Рис.12. Спектри ЕПР комплексів Мо(V) у розчинах HCl (І), HBr (VI) і у змішаних розчинах HCl + HBr (IIV) при 293 К:1 – MoOBr4Y'; 2 – MoOClBr3Y'; 3 – MoOCl2Br2Y'; ; 4 – MoOCl3BrY'; 5 – MoOCl4Y'
Таким чином, викладені вище результати показують, що спектр Мо(V) в змішаних розчинах HCl + HBr є суперпозицією спектрів комплексів MoOCl4-jBrjY. Параметри кожного з них наведено в табл. 3.
Таблиця 3. Параметри спін-гамільтоніана змішаних оксогалогенокомплексів Мо(V)
|
Комплекс |
go0.003 |
ao 2, Гс |
|
MoOCl4Y |
1.948 |
47 |
|
MoOCl3BrY |
1.960 |
44 |
|
MoOCl2Br2Y |
1.970 |
43 |
|
MoOClBr3Y |
1.983 |
42 |
|
MoOBr4Y |
1.994 |
40 |
Дослідження спектрів ЕПР координаційних сполук у розчинах, крім певних переваг, мають і свої недоліки. По-перше, внаслідок швидкого обертання молекул у розчині під впливом броунівського руху анізотропні ефекти практично повністю усереднюются, і спектри ЕПР розчинів стають ізотропними, тобто вони не дають інформацію про симетрію найближчого оточення центрального атому. По-друге, як уже вказувалося вище, досить часто в результаті швидких процесів хімічного обміну лінії уширюються, що іноді не дає змогу взагалі спостерігати в спектрах надтонку і особливо додаткову надтонку (див. нижче) структури. Подолати ці недоліки і об’єднати переваги спектрів ЕПР полікристалічних зразків і рідких розчинів дає методика дослідження спектрів у заморожених склоподібних розчинах.

 а
а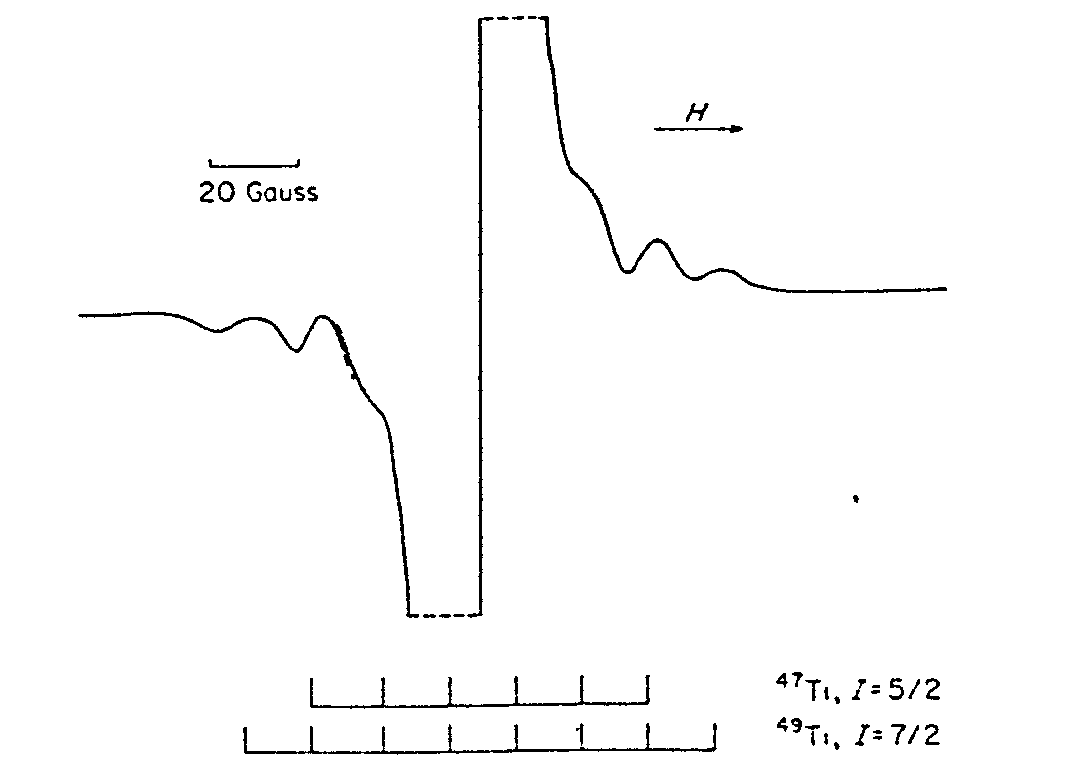 б
б в
в