
- •Министерство образования и науки российской федерации
- •Список сокращений
- •Глава 1. Обзор литературы
- •Нейродегенерация и актиновый цитоскелет
- •1.2. Limk1 как ключевой фермент ремоделирования актина
- •1.3. Нейродегенерация и белки теплового шока
- •1.4. Бтш70: структура и основные функции
- •1.5. Нейродегенерация и нейротрофические факторы – подходы к терапии
- •1.6. Gdnf и его функциональная роль
- •1.7. Взаимосвязь сетей трансдукции limk1, gdnf и бтш
- •Глава 2. Материал и методы исследования
- •2.1. Материал исследования
- •2.2. Воздействие тепловым шоком
- •2.3. Иммунофлюоресцентный анализ распределения бтш70
- •2.4. Иммунофлюоресцентный анализ распределения gdnf
- •3.1.2. Распределение бтш70 у линий дрозофилы с полиморфизмом по гену limk1 после теплового шока
- •3.1.3. Распределение gdnf у линий дрозофилы с полиморфизмом по гену limk1 в норме
- •3.1.4. Распределение gdnf у линий дрозофилы с полиморфизмом по гену limk1 после теплового шока
- •3.2. Обсуждение.
- •Заключение
1.2. Limk1 как ключевой фермент ремоделирования актина
LIM-киназа 1 (LIMK1) важнейший узел сигнального каскада ремоделирования актина, который определяет состояние актина в клетке. После активации LIMK1 фосфорилирует кофилин и смещает соотношение G-актин/F-актин в сторону образования F-актина. При нарушении одного из узлов каскада происходит образование кофилин-актиновых комплексов, которые накапливаются в аксонах и дендритах нейронов, тем самым блокируют везикулярный транспорт, что является причиной атрофии нейритов.
LIMK1 регулирует организацию актинового цитоскелета путем инактивации фосфорилирования актина и деполяризации белка кофилина. LIMK1 фосфорилирует кофилин в положении серина, который препятствует деполимеризации актина и приводит к накоплению F-актина. LIMK1 также регулирует стабильность микротрубочек путем фосфорилирования p25/TPPP (белка полимеризации тубулина), который дестабилизирует микротрубочки. Активированный белок LIMK1 ассоциируется с гамма-тубулином в центросоме в течение митотического цикла (рис. 5) (Gorovoy et al., 2005).

Рис. 5. Участие LIMK1 в процессах дестабилизации микротрубочек и формирования стрессорных фибрилл (по: Gorovoy et al., 2005).
LIMK1 - многофункциональный белок, который участвует в регуляции клеточной подвижности, клеточного цикла, цитокинеза и клеточной морфологии. LIMK1 также регулирует рост нейритов, синаптическую стабильность, подвижность конуса роста, формирование аксонов путем модуляции динамики комплекса Гольджи и нейрональную дифференцировку.
В состав белка LIMK1 входят два LIM-домена (LIM – аббревиатура от продуктов генов, где эти домены были впервые обнаружены: Lin-11, Isl-1 и Mec-3), каждый из которых содержит два мотива цинковых пальцев; один PDZ-домен (PDZ – аббревиатура от названий трех белков: PSD95, DLG, ZO-1); домен SMC-pork A (SMC - structural maintenance of chromosomes, домен для поддержания структуры хромосом) и киназный домен (Nagata et al., 1999).
Белки, содержащие PDZ-домен, являются ключевыми молекулами в организации постсинаптической области в нейромышечных контактах (Rivlin et al., 2004). PDZ – это домены необходимые для образования супрамолекулярных комплексов сигнальной трансдукции и организации ядерно-цитоплазматического транспорта (Gorovoy et al., 2005). Домен SMC-pork A аналогичен белку SMC-pork A. Этот белок обеспечивает поддержание структуры хромосом при сегрегации в ходе клеточного деления.
LIMK1 в клетке представлена пятью изоформами – А, С, D, F и E. С и D - наиболее значимые из этих пяти изоформ и различаются по функциональной активности (рис. 6).
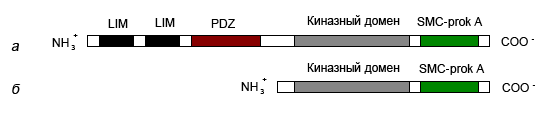
Рис. 6. Доменная структура изоформ LIMK1 D. melanogaster: а – изоформа С, б – изоформа D (по: the National Centre for Biotechnology Information (NCBI), www.ncbi.nlm.nih.gov).
C-изоформа - полноразмерный белок длиной 1257 аминокислот, содержащий два LIM и один PDZ домена, киназный домен и домен SMC-pork A. D-изоформа примерно на 200 аминокислотных остатков короче, чем форма С, за счет отсутствия LIM- и PDZ-доменов и поэтому обладает более высокой киназной активностью (Edwards et al., 1999), поскольку LIM- и PDZ-домены ингибируют киназный домен (Nagata et al., 1999).
LIMK1 принимает участие в регуляции внутриклеточного транспорта белков к аппарату Гольджи, стимулируя специализированную организацию актиновых филаментов (Salvarezza et al., 2009). Транспорт LIMK1 в ядро осуществляется за счет взаимодействия сигнала ядерной локализации, который находится между PDZ и киназным доменами. Оказавшись в ядре, LIMK1 фосфорилирует транскрипционный фактор CREB, тем самым, вызывая активацию CREB-зависимых промоторов генов, таких как c-fos, zif/268, somatostatin и bdnf (Yang et al., 2004).
LIMK1 в ядре выполняет двоякую функцию: во-первых, участвует в динамике внутриядерного актина (Krauss et al., 2003), находящегося в ядре в форме связанных с кофилином олигомеров (Pendleton et al., 2003); во-вторых, мишенью LIMK1 могут быть транскрипционные факторы CREB (cAMP response element-binding protein, CREB) и Nurr1 (Nuclear receptor related 1 protein, Nurr1) (Scott, Olson, 2007).
LIMK1 является частью сигнального каскада: рецепторы - малые ГТФазы - актиновый цитоскелет. В финальном звене этого каскада очень важны взаимодействия актинового цитоскелета. И тут важную роль играют трансмембранные белки, они взаимодействуют как с внеклеточными молекулами, так и с внутриклеточными белками цитоскелета. Одним из таких важных семейств белков являются интегрины. Интегрины - обширное суперсемейство рецепторов клеточной поверхности. Они гомологичны для молекул межклеточного матрикса, таких как коллаген, фибронектин (рис.7).

Рис. 7. Взаимодействие интегринов с актиновым цитоскелетом и межклеточным матриксом (по: Campbell, Reece, 2002).
Интегрины участвуют в передаче информации из внеклеточной среды в клетку, определяя таким образом направление её дифференцировки, форму, митотическую активность, способность к миграции (Северина, 2003).
Благодаря трансмембранной ориентации интегрины переносят сигналы от внеклеточного матрикса к цитоскелету. Большинство интегринов связано с цитоплазматическими С-концевыми участками с актин-связывающими белками клеток. При соединении лиганда β-субъединицы связывающихся интегринов взаимодействуют с белками «прикрепления» - талином и α-актинином, которые, в свою очередь, инициируют сборку других соединительных белков. Таким образом, происходит связывание интегринов с актиновыми филаментами (рис. 8).

Рис. 8. Связывание интегринов с актиновыми филаментами (по: Freeman, 2005).
Актиновые филаменты через интегрины могут изменять ориентацию секретируемых молекул фибронектина во внеклеточном матриксе (Вавилова, 2008). В свою очередь, LIMK1 координирует разборку микротрубочек и полимеризацию актиновых филаментов. Микротрубочки определяют не только внутриклеточную локализацию органелл и их перемещение в цитоплазме в процессе функционирования, но и являются компонентами сигнальной трансдукции (Gundersen, Cook, 2005).
Динамика микротрубочек регулируется двумя группами белков: стабилизирующие (microtubule-associated proteins MAPs и tau) и дестабилизирующие (stathmin и SCG10 (superior cervical ganglia 10)). Кроме прямого участия LIMK1 в реорганизации микротрубочек, возможно и ее опосредованное действие через фосфорилирование этих белков. Таким образом, LIMK1 опосредует стрессорную реакцию клетки, что выражается в появлении стресс-фибрилл, деассоциации микротрубочек и изменении морфологии клетки (Gorovoy et al., 2005).
Стабильность самой LIMK1 обеспечивается за счет образования гомодимера и трансфосфорилирования, в котором принимает участие один из белков теплового шока – БТШ90 (Li et al., 2006). Поэтому, в качестве одного из ведущих факторов регуляции активности LIMK1 рассматривают семейство белков теплового шока.
