
- •Распределение программного материала по лабораторным работам дисциплины «Химия» для групп суз-109,110,111
- •Комплект заданий для выполнения расчетной работы по дисциплине «Химия»
- •Примерный комплект заданий для рубежного контроля
- •Вопросы для обсуждения на семинарских (практических) занятиях по дисциплине «Химия»
- •1. Классификация неорганических соединений.
- •2. Основные понятия и законы химии.
- •3. Строение атома. Периодическая система д.И. Менделеева. Периодичность свойств химических элементов
- •4. Химическая связь и пространственное строение молекул
- •5. Химическая термодинамика.
- •6. Химическая кинетика и равновесие
- •7. Растворы. Виды концентраций растворов.
- •8. Теория электролитической диссоциации. Сильные и слабые электролиты. Степень диссоциации
- •9. Ионные реакции в водных растворах. Смещение ионного равновесия.
- •10. Ионное произведение воды. Водородный показатель
- •11. Гидролиз солей.
- •12. Коллоидные растворы
- •13. Окислительно-восстановительные реакции
- •14. Электролиз. Законы Фарадея.
- •15. Электродный потенциал. Гальванический элемент
- •16. Коррозия металлов и методы защиты.
- •17. Определение жесткости и умягчения воды.
- •Вопросы для коллоквиумов, собеседования по дисциплине «Химия»
- •Раздел 1.
- •Раздел 2
3. Строение атома. Периодическая система д.И. Менделеева. Периодичность свойств химических элементов
Опишите строение атома.
Из каких частиц состоит атомное ядро?
Что такое изотопы и изобары?
Какие типы радиоактивности и радиоактивного распада Вам известны?
Сформулируйте законы смещения.
В чем заключается сущность квантовомеханического подхода к описанию
микромира?
Что такое атомная орбиталь?
Какими параметрами описывается атомная орбиталь?
Что характеризуют главное, побочное, магнитное и спиновое квантовые чис-
ла?
Сформулируйте правило Клечковского.
Сформулируйте принцип Паули и правило Хунда.
Что такое электронная формула атома?
Какие электроны в атоме являются валентными?
Чем определяется принадлежность химического элемента к тому или иному
электронному семейству?
Сформулируйте периодический закон.
Как связаны периодически изменяющиеся свойства элементов со строением
электронных оболочек?
Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого равно 2? 4?
Приведите квантовые числа для всех электронов атома углерода.
Какой подуровень заполняется в атомах после 6s-подуровня?
Структура валентного электронного слоя атома элемента выражается формулой 3d5 4s1/
Приведите электронные и электронно-графические формулы элементов с зарядом ядра а) 17, б) 43, в) 74.
На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных
подгруппах?
Приведите электронные формулы ионов Sn+4, Cr+3, S-2?
Чем можно объяснить особую устойчивость электронной конфигурации иона Fe+3?
Определить по правилу Клечковского последовательность заполнения электронных подуровней, характеризующихся суммой главного и побочного квантовых чисел
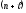 а) 5, б) 7?
а) 5, б) 7?У какого элемента начинает заполняться подуровень 4f? У какого элемента завершается заполнение этого уровня?
4. Химическая связь и пространственное строение молекул
Каковы механизмы образования ковалентной связи?
Перечислите свойства ковалентной связи.
Чем обусловлена геометрическая форма молекул?
Чем различаются основные положения методов ВС и МО?
Что такое ионная связь?
Что такое металлическая связь?
Опишите типы межмолекулярных взаимодействий.
Сформулируйте основные положения зонной теории твердого тела.
В каких молекулах химическая связь имеет полярный характер: F2, CO, N2, HBr?
Определите валентность фтора и фосфора в основном и возбужденном состояниях.
Укажите механизм образования химических связей в молекулах СО, воды, гидроксида аммония, катиона аммония.
Приведите электронные конфигурации молекул кислорода, хлороводорода, по методу МО.
С помощью метода МО определите возможно ли образование ионов Н2+, Не2+, О2-.
Нарисуйте энергетические диаграммы молекул азота,фтора по методу МО.
Какие виды вандерваальсовых сил присутствуют в молекулах перекиси водорода, воды, бромоводорода, этилового спирта, метаналя?
От каких параметров зависит длина химической связи?
Как изменяется энергия химической связи в ряду галогеноводородов от фтороводорода до иодоводорода?
Как изменяется энергия химической связи между углеродами в ряду: одинарная, двойная, тройная, ароматическая?
