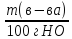- •Техника безопасности при работе в химической лаборатории.
- •Лабораторная химическая посуда.
- •2.2. Посуда специального назначения
- •2.3. Мерная посуда
- •2.4. Фарфоровая посуда
- •2.5. Подготовка стеклянной посуды к работе
- •Оформление лабораторной работы и записи в лабораторном журнале.
- •Классификация и номенклатура неорганических соединений
- •Тема 1 Основные законы и понятия химии. Понятие эквивалента. Определение эквивалента простого вещества и соединений.
- •Лабораторная работа 1 определение молярной массы эквивалента металла по водороду.
- •Тема 2. Классификация реактивов по степени чистоты. Методы очистки твердых веществ и газов.
- •Выбор растворителя.
- •Возгонка (сублимация).
- •Лабораторная работа №2 Очистка кристаллических веществ.
- •Экспериментальные и расчетные данные
- •Тема №3. Способы выражения концентрации растворов. Методы приготовления растворов.
- •Лабораторная работа №3 Получение насыщенного раствора соли. Приготовление растворов методом разбавления
- •Тема 4 Скорость химической реакции
- •Лабораторная работа 7. Определение константы скорости каталитического разложения пероксида водорода.
- •Лабораторная работа 8 Химическое равновесие Теоретическая часть
- •Тема 5 Буферные растворы
- •Расчет pH ацетатного буферного раствора
- •Расчет pH аммиачного буферного раствора
- •Определение буферной емкости
- •Лабораторная работа №9 Буферные растворы
- •Тема 6 Гидролиз
- •Лабораторная работа №10 Гидролиз соединений
- •Растворимость.
- •Гетерогенное равновесие в растворах электролитов.
- •Произведение растворимости.
- •Лабораторная работа №11 Гетерогенное равновесие в растворах электролитах. Произведение растворимости
- •Тема 8. Комплексные соединения
- •Комплексные соединения
- •Лабораторная работа №12. Комплексные соединения.
- •Тема 9 Окислительно-восстановительные процессы.
- •Лабораторная работа 13 окислительно-восстановительные реакции
- •Выполнение работы
- •Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция
- •Приложение.
Экспериментальные и расчетные данные
|
Вещество г |
Объем воды, мл |
Масса соли, г |
Выход соли, % | ||
|
исходная |
полученная
| ||||
|
|
|
|
|
| |
Контрольные вопросы.
Какие из перечисленных реакций протекают с выделением теплоты: а) горение угля; б) ржавление железа; в) разложение соли калия при нагревании; г) процессы окисления питательных веществ в организме человека?
Для чего необходимо измельчать или растворять твердые вещества перед проведением реакций между ними? Выберите правильный ответ: а) для увеличения площади соприкосновения реагирующих веществ;б) реакции между твердыми веществами не протекают; в) для ускорения протекания реакций; г) для увеличения числа столкновений частиц реагирующих веществ.
Как влияет сжигание твердого топлива на окружающую среду? Выберите правильный ответ: а) при неполном сжигании в атмосферу попадают твердые частицы, загрязняющие воздух; б) при полном сжигании выделяется углекислый газ, необходимый растениям для процессов фотосинтеза; в) не изменяет состав воздуха; г) улучшает.
Чем отличается химическая реакция от физического процесса? Как влияет химическая реакция на состав вещества? Выберите правильный ответ: а) при химической реакции не изменяется состав вещества; б) при физическом явлении не изменяется состав вещества; в) при химической реакции состав вещества изменяется; г) не отличается.
Какие условия необходимы для полного сжигания твердого топлива: а) доступ воздуха; б) измельчение топлива и доступ воздуха; в) высокая температура; г) постоянное нагревание?
Растворимость дихромата калия равна 12,5 г/100 г Н2О при 20 ⁰С. Какова масса насыщенного раствора этой соли, если для приготовления раствора было использовано 400 мл воды?
Путем выпаривания воды из 243 г насыщенного при 20 ⁰С раствора карбоната натрия получено 43 г безводной соли. Чему равна растворимость этой соли при данной температуре?
Коэффициент растворимости бромида калия при температуре 20 ⁰С равен 65,2 г /100 г Н2О. Определите массовую долю бромида калия в насыщенном растворе при данной температуре.
Массовая доля хлорида меди (II) в насыщенном растворе этой соли при температуре 20 ⁰С равна 42,7 %. Определите коэффициент растворимости хлорида меди при данной температуре в г/100 г Н2О.
При температуре 30 оС в воде массой 100 г растворяется бромид аммония массой 81,8 г. При охлаждении 300 г данного раствора до 0 ⁰С выпадает в осадок 36,8 г соли. Определите, какая масса бромида аммония может быть растворена в воде массой 100 г при температуре 0 ⁰С?
Тема №3. Способы выражения концентрации растворов. Методы приготовления растворов.
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах.
Всякий раствор состоит из растворенных веществ и растворителя, среды, в которой эти вещества равномерно распределены в виде молекул и ионов. Растворителем обычно считается тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если оба компонента до растворения находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве.
Количественное отношение растворенного вещества и растворителя х выражаются в виде концентрации раствора. Растворы с большой концентрацией растворенного вещества называются концентрированными, с малой – разбавленными. В химической практике наиболее употребительны следующие способы выражения концентраций:
Массовая доля w(x) - есть отношение массы растворенного вещества к массе раствора. Выражается в долях или процентах.
Молярная концентрация C(x) – отношение количества вещества n(x) (в молях) к объему раствора V (в литрах). Размерность: моль/л
C(x)
=
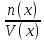
Например, выражение C(H2SO4) = 1 моль/л обозначает раствор серной кислоты, в каждом литре которого содержится один моль (98 г) серной кислоты.
Моляльная концентрация или моляльность b(x) раствора определяется как отношение количества вещества n(x) растворенных частиц x к массе m растворителя:
b(x)
=
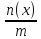
Например, b(H2SO4)(H2O) = 1 моль/кг означает, что 1000 г воды растворена серная кислота количеством вещества 1 моль.
Растворы, в которых устанавливается динамическое равновесие между растворяемым веществом в растворе и в твердой фазе, называются насыщенными. Молярная концентрация насыщенного раствора называется растворимостью вещества. На практике часто используют для расчетов понятие коэффициента растворимости – Р.
P
=