
- •Техника безопасности при работе в химической лаборатории.
- •Лабораторная химическая посуда.
- •2.2. Посуда специального назначения
- •2.3. Мерная посуда
- •2.4. Фарфоровая посуда
- •2.5. Подготовка стеклянной посуды к работе
- •Оформление лабораторной работы и записи в лабораторном журнале.
- •Классификация и номенклатура неорганических соединений
- •Тема 1 Основные законы и понятия химии. Понятие эквивалента. Определение эквивалента простого вещества и соединений.
- •Лабораторная работа 1 определение молярной массы эквивалента металла по водороду.
- •Тема 2. Классификация реактивов по степени чистоты. Методы очистки твердых веществ и газов.
- •Выбор растворителя.
- •Возгонка (сублимация).
- •Лабораторная работа №2 Очистка кристаллических веществ.
- •Экспериментальные и расчетные данные
- •Тема №3. Способы выражения концентрации растворов. Методы приготовления растворов.
- •Лабораторная работа №3 Получение насыщенного раствора соли. Приготовление растворов методом разбавления
- •Тема 4 Скорость химической реакции
- •Лабораторная работа 7. Определение константы скорости каталитического разложения пероксида водорода.
- •Лабораторная работа 8 Химическое равновесие Теоретическая часть
- •Тема 5 Буферные растворы
- •Расчет pH ацетатного буферного раствора
- •Расчет pH аммиачного буферного раствора
- •Определение буферной емкости
- •Лабораторная работа №9 Буферные растворы
- •Тема 6 Гидролиз
- •Лабораторная работа №10 Гидролиз соединений
- •Растворимость.
- •Гетерогенное равновесие в растворах электролитов.
- •Произведение растворимости.
- •Лабораторная работа №11 Гетерогенное равновесие в растворах электролитах. Произведение растворимости
- •Тема 8. Комплексные соединения
- •Комплексные соединения
- •Лабораторная работа №12. Комплексные соединения.
- •Тема 9 Окислительно-восстановительные процессы.
- •Лабораторная работа 13 окислительно-восстановительные реакции
- •Выполнение работы
- •Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция
- •Приложение.
Тема 6 Гидролиз
При растворении вещества в воде протекает ряд последовательных реакций:
Гидратация молекул соединения.
Диссоциация на ионы и гидратация анионов и катионов.
Гидролиз.
Под гидратацией понимается процесс координации молекул воды вокруг иона или молекулы в растворе. Например,
Al3+ + 6H2O = Al(H2O)63+
Чем выше поляризующая способность иона, определяемая отношением заряда иона к его размеру, тем выше энергия гидратации и, значит, способность иона к гидратации. Гидролизу в водных растворах подвергаются только катионы слабых оснований или анионы слабых кислот. Их сродство к воде настолько велико, что ведет к разрыву связей H-O-H и образованию слабых электролитов. При этом освобождаются ионы H+ или OH-, следовательно, происходит изменение pH среды. Примером гидролиза соли, образованной слабым основанием и сильной кислотой (гидролиз по катиону) может служить AlCl3. Приведем уравнение (1)., отражающее суть гидролиза с учетом механизма диссоциации (а) и гидратации (б):
Al3+ + H2O <=> Al (OH)2+ + H+ (а)
(1)
[Al(H2O)6]3+ <=> [Al(H2O)5OH]2+ + H+ (б)
Таким образом, гидролизом называется реакция взаимодействия ионов растворенной соли с водой, в результате которой происходит разложение молекул воды и образование слабых электролитов, как правило, приводящие к изменению pH раствора.
Гидролизу подвергаются: катионы – Al3+, Cr3+, Fe3+, Cu2+, Zn2+, Fe2+, Mn2+, NH4 и т.д. анионы – NO2-, Cr2O72-, S2-, CN-, CH3COO-, PO43-, ClO4- и т.д.
Примером гидролиза солей, образованных сильным основанием и слабой кислотой (гидролиз по аниону) может быть реакция:
CH3COONa + HOH <=> CH3COOH + NaOH (2)
CH3COO- + HOH <=> CH3COOH + OH-
Ионы CH3COO- взаимодействуют с ионами Н+ воды, образую молекулы слабодиссоциированной уксусной кислоты. Ионы же Na+ не связываются с OH-, так как NaOH – сильный электролит.
В результате происходит накопление свободных ионов OH-, что обуславливает создание щелочной среды, pH > 7.
При добавлении к раствору ацетата натрия сильной кислоты, например, HCl, происходит усиление гидролиза, так как ионы OH- связываются с ионами H+ и для сохранения равновесия должна образоваться новая порция кислоты CH3COOH с высвобождением OH- ионов из воды.
Добавка щелочи к раствору CH3COONa, наоборот, подавляет гидролиз, так как возрастает концентрация продуктов реакции (ионов OH-) и для восстановления равновесия часть ионов OH- должна прореагировать с кислотой, с образованием соли и воды.
Гидролиз – процесс обратимый. При равенстве скоростей процесса гидролиза и обратного ему процесса (как называется процесс ? ) устанавливается равновесие, которое характеризуется константой гидролиза. Выражение константы гидролиза Кг зависит от природы соли, подвергающей гидролизу.
КгCH3COOH
=
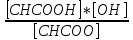 ; [H2O]
– const
; [H2O]
– const
Более правильным является выражение Кг в терминах активности:
Кг
=
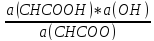
Если числитель и знаменатель (2) домножить на a(H+), то Кг можно записать в виде:
Кг
=
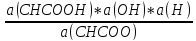 =
=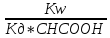 ,
,
Где Kw = a(H+) * a(OH-) – ионное произведение воды.
Кд – константа диссоциации уксусной кислоты.
Можно рассчитать pH соли, подвергшейся гидролизу. Для этого надо учесть, что в результате гидролиза солей одноосновных кислот активности продуктов гидролиза равны. Для ацетатной соли в соответствии с уравнением реакции(1): a(CH3COOH) = a(OH-). Тогда из (2) и (3):
a
2(OH-)
= Кг
* a(CH3COO-)
=
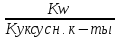 * a(CH3COO-)
* a(CH3COO-)
При гидролизе разбавленных растворов можно считать, что a(CH3COO-) = Cсоли; f 1
a(
OH-)
=
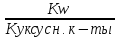 ×
Cсоли
×
Cсоли
pOH
= 7-
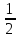 pKуксусн.к-ты
-
pKуксусн.к-ты
-
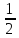 lg
Cсоли
lg
Cсоли
pH
= 14 – pOH = 7 +
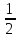 pKуксусн.к-ты
+
pKуксусн.к-ты
+
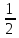 lg
Cсоли
lg
Cсоли
Если подвергается гидролизу соль двухосновной кислоты, например, угольной, которая диссоциирует ступенчато и характеризуется двумя константами ионизации
