
- •Техника безопасности при работе в химической лаборатории.
- •Лабораторная химическая посуда.
- •2.2. Посуда специального назначения
- •2.3. Мерная посуда
- •2.4. Фарфоровая посуда
- •2.5. Подготовка стеклянной посуды к работе
- •Оформление лабораторной работы и записи в лабораторном журнале.
- •Классификация и номенклатура неорганических соединений
- •Тема 1 Основные законы и понятия химии. Понятие эквивалента. Определение эквивалента простого вещества и соединений.
- •Лабораторная работа 1 определение молярной массы эквивалента металла по водороду.
- •Тема 2. Классификация реактивов по степени чистоты. Методы очистки твердых веществ и газов.
- •Выбор растворителя.
- •Возгонка (сублимация).
- •Лабораторная работа №2 Очистка кристаллических веществ.
- •Экспериментальные и расчетные данные
- •Тема №3. Способы выражения концентрации растворов. Методы приготовления растворов.
- •Лабораторная работа №3 Получение насыщенного раствора соли. Приготовление растворов методом разбавления
- •Тема 4 Скорость химической реакции
- •Лабораторная работа 7. Определение константы скорости каталитического разложения пероксида водорода.
- •Лабораторная работа 8 Химическое равновесие Теоретическая часть
- •Тема 5 Буферные растворы
- •Расчет pH ацетатного буферного раствора
- •Расчет pH аммиачного буферного раствора
- •Определение буферной емкости
- •Лабораторная работа №9 Буферные растворы
- •Тема 6 Гидролиз
- •Лабораторная работа №10 Гидролиз соединений
- •Растворимость.
- •Гетерогенное равновесие в растворах электролитов.
- •Произведение растворимости.
- •Лабораторная работа №11 Гетерогенное равновесие в растворах электролитах. Произведение растворимости
- •Тема 8. Комплексные соединения
- •Комплексные соединения
- •Лабораторная работа №12. Комплексные соединения.
- •Тема 9 Окислительно-восстановительные процессы.
- •Лабораторная работа 13 окислительно-восстановительные реакции
- •Выполнение работы
- •Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция
- •Приложение.
Тема 4 Скорость химической реакции
Одной из основных задач химии является изучение влияния различных факторов на скорость химических реакций.
Скорость химической реакции равна числу актов химического взаимодействия между реагирующими веществами за единицу времени в единице объема для реакций, протекающих в гомогенной системе (для гомогенных реакций) или на единицу поверхности раздела фаз для гетерогенных реакций. Скорость гомогенной реакции количественно можно определить изменением молярной концентрации любого участника реакции в единицу времени.
Для реакции А + В = С.
Vt
= -
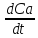 = -
= - = -
= -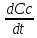
Мгновенная скорость – это скорость реакции в данный момент времени t. Она определяется как производная концентрации по времени.
Vt
=

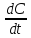
и равна тангенсу угла наклона кривой C = f(t) в данной точке
Скорость химической реакции всегда остается положительной, т.к. концентрация исходного вещества уменьшается (изменение концентрации в этом случае берется со знаком минус).
Для элементарной реакции (реакции, идущей в одну стадию) справедлив основной закон химической кинетики (закон действия масс). Скорость элементарной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции:
aA + bB = Cc
v = kCAa CBb
CA, CB – молярные концентрации реагирующих веществ А и В;
k – коэффициент пропорциональности, называемый константой скорости данной реакции.
Коэффициент пропорциональности равен скорости, если концентрации CA0 и CB0 равны единице. Константа скорости зависит от природы реагирующих веществ и температуры, катализатора, площади поверхности раздела фаз (для гетерогенных реакций).
Важным понятием в химической кинетике является понятие «порядок реакции». Различают формальный порядок реакций, который определяется как сумма стехиометрических коэффициентов в уравнении химической реакции. Если уравнение реакции не определяет ее механизм (реакция не является элементарной, не протекает в одну стадию), порядок реакции не определяется стехиометрическими коэффициентами. Реакции, скорость которых не зависит от концентрации (например, гетерогенные реакции) реагирующих веществ, имеют нулевой порядок. Подавляющее большинство химических реакций протекает в несколько стадий и реальный порядок реакции не совпадает с формальным порядком. Реальный порядок реакции определяется экспериментально.
Порядок реакции характеризует зависимость скорости от концентрации. Общий (суммарный) кинетический порядок реакции – сумма показателей степеней при концентрациях реагирующих веществ в уравнении скорости реакции, определенных экспериментально. Это реальный порядок реакции.
Реальный порядок реакции определяют, используя опытные данные об изменении концентрации реагирующих веществ со временем. Если в реакции принимает участие несколько веществ, необходимо определить частные порядки по отношению к каждому из этих веществ.
Лабораторная работа 7. Определение константы скорости каталитического разложения пероксида водорода.
В настоящей работе предлагается измерить скорость разложения пероксида водорода в присутствии катализатора при комнатной температуре (6). Реакция разложения может быть представлена следующими уравнениями:
Н2О2 = Н2О + О (1)
2О = О2 (2)
Можно предположить, что суммарная скорость реакции определяется первой стадией как более медленной, поэтому скорость реакции зависит от концентрации перексида водорода:
V1 = k1C(H2O2) (3)
В разбавленных растворах H2O2 разложение его определяется неустойчивостью самих молекул H2O2 и проходит по уравнению (1).
Сумма степеней, в которых стоят концентрации веществ в кинетическом уравнении, описывающем скорость процесса, называется порядком реакции. В уравнении (3) концентрации пероксида водорода стоит в первой степени, следовательно, реакция (1) – реакция первого порядка.
Можно предположить, что в концентрированных растворах пероксид водорода претерпевает разложение из за столкновения молекул:
H2O2 + H2O2 = 2 H2O + 2О (4)
В этом случае скорость реакции зависит от концентрации по уравнению:
V2 = k2C2(H2O2) (5)
Разложение по уравнению (1) является реакцией второго порядка, так как в уравнении (5) концентрация стоит во второй степени. По зависимости скорости от концентрации (уравнение (3) или (5)) определяют порядок реакции.
Коэффициент пропорциональности k в уравнениях (3) и (5) называются константой скорости реакции. Константа скорости – постоянная величина только при условии сохранения неизменными всех условий опята. Она зависит от температуры, количества и качества катализатора, формы и объема реакционного сосуда и ряда других факторов, но в одном и том же опыте сохраняется постоянной, если в ходе реакции не изменяется механизм процесса.
Порядок реакции определяется следующим способом. По уравнению (3) вычисляют константу скорости реакции. Если она сохраняется постоянной в течение опыта, то это будет доказательством того, что изучаемая реакция – реакция первого порядка; если же константа скорости сохраняет постоянство при вычислении по уравнению (5), то изучаемая реакция – реакция второго порядка.
В предлагаемом эксперименте используется раствор пероксида водорода небольшой невысокой концентрации. Изменение скорости подчиняется уравнению (3), т.е. процесс представляет собой реакцию первого порядка.
Изменение скорости разложения пероксида водорода основано на определении концентрации его в любой данный момент времени. Из-за непрерывного уменьшения концентрации H2O2 скорость постепенно уменьшается, поэтому скорость реакции максимальна в начале реакции и стремится к нулю по мере расходования H2O2.
Выбор вещества, концентрация которого изменяется в ходе реакции, связан только с удобством проведения опыта. Для изучаемого процесса достаточно определить изменение концентрации от времени одного из веществ: пероксида водорода, воды или кислорода. Наблюдать за скоростью реакции по количеству образовавшейся воды неудобно. Лучше всего определить концентрацию пероксида водорода титрованием или по объему выделившегося кислорода. В данной работе предлагается воспользоваться последним методом.
В обычных условиях скорость разложения пероксида водорода невелика, поэтому процесс проводится в присутствии катализатора. Ускоряют разложение H2O2 многие вещества: стекло, платина, уголь, соли и оксиды ряда металлов, в том числе диоксид марганца.
Выполнение эксперимента.
Для определения количества выделившегося к данному моменту времени пероксида водорода воспользуйтесь прибором, используемом при определении эквивалента металла.
Соберите прибор. В уравнительный сосуд налейте воду, которая заполняет бюретку и вытесняет из прибора избыток воздуха через открытый кран. Бюретку укрепить на штативе так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением. Для удобства отсчетов бюретку целесообразно опустить до положения нулевого деления на уровне глаз наблюдателя. Отсчеты уровня жидкости делайте по нижнему краю мениска. Одно малое деление бюретки составляет 0,1 мм. На глаз вполне возможно определить расположение мениска, разделив расстояние между двумя малыми делениями на четыре части, поэтому отсчеты делайте с точностью до 0,025-0,03 мм и в рабочем журнале все записи объемов записывайте с сотыми долями миллиметра.
Отрежьте стеклянную палочку диаметром 0,5-0,6 см и длиной 3 см. Стеклянная палочка должна легко проходить в пробирку Оствальда (вместо стекла можно взять металлическую пластинку). Погрузите самый кончик стеклянной палочки в раствор коллодия или клея БФ. Дайте стечь избытку клея, затем сразу прикоснитесь им к поверхности тонко измельченного порошка MnO2- катализатора, чтобы несколько его частичек прилипли к палочке. Дайте просохнуть (5-10 мин).
Вычислите, сколько миллиметров имеющегося в лаборатории раствора пероксида водорода известной концентрации (1-3%-ый раствор H2O2) следует взять, чтобы при полном разложении H2O2 в условиях опыта (температура, атмосферное давление) выделился кислород в количестве, равном ¾ объема бюретки. Отмерьте градуированной пипеткой нужное количество раствора пероксида водорода в одно из колен пробирки. Долейте дистиллированной воды столько, чтобы уровень раствора был на 2-3 см ниже спая колен пробирки Оствальда. В другое колено поместите палочку с катализатором. Часть стеклянной палочки, покрытая порошком, должна находиться на дне пробирки.
Затем в пробирку и бюретку плотно вставьте пробки с продетыми через них трубками, а кран закройте: прибор, таким образом, отъединяется от внешней среды и бюретка соединяется теперь только с пробиркой.
Установите уровни воды в бюретке и уравнительном сосуде, проверьте прибор еще раз на герметичность. Приведите давление в приборе к атмосферному (уровни воды в бюретке и уравнительном сосуде должны быть на одной горизонтальной плоскости).
Запишите с точностью до 0,025-0,03 мл деление бюретки, где находится уровень воды (по нижнему краю мениска). Перелейте жидкость в колено с катализатором, для этого поверните пробирку и одновременно, по часам или секундомеру, отметьте время начала реакции. Кислород, выделяющийся в результате разложения пероксида водорода, вытесняет из бюретки воду. Уравнительный сосуд при этом опускайте и во время опыта старайтесь держать воду в нем и в бюретке на одном уровне, чтобы давление газа внутри прибора было все время близким к атмосферному. Первые 10 минут записывайте уровень воды в бюретке каждую минуту, следующие полчаса – каждые 2 минуты, и еще полчаса - каждые 5 минут. Опыт можно закончить, когда за 10 минут уровень воды в бюретке смещается не больше чем на 1-2 мм.
К концу опыта реакция сильно замедляется, и, чтобы определить объем выделившегося кислорода при практически полном разложении пероксида водорода, потребовались бы десятки часов. Поэтому опустите колено пробирки Оствальда с реакционной смесью в стакан с горячей водой (80-900С). После окончания реакции (примерно через 10 минут) дайте прибору остыть, и, приведя давление в нем к атмосферному, запишите объем всего выделившегося кислорода.
При обработке результатов полагаем, что реакция разложения пероксида водорода является реакцией первого порядка. (Это будет подтверждено постоянством констант скорости реакции, вычисленных по уравнению (3)). Определить константу скорости исследуемой реакции.
Контрольные вопросы.
В чем заключается физический смысл константы скорости химической реакции? От каких факторов она зависит?
Объясните правило Вант-Гоффа.
Что такое температурный коэффициент скорости реакции?
В системе СО + Cl2 = COCl2 концентрацию оксида углерода (II) увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора от 0,02 до 0,06 моль/л. Вычислите, во сколько раз возросла скорость прямой реакции.
Вычислите, как изменится скорость реакции 2NO + O2 → 2NO2, если давление этой химической системы, находящейся в замкнутом сосуде, увеличить в два раза.
Реакция протекает по уравнению N2 + 3H2 ↔ 2NH3. Вычислите, как изменится скорость прямой реакции, если концентрацию N2 увеличить в 3 раза, а H2 в пять раз.
Рассчитайте, во сколько раз уменьшится скорость реакции 2NO + O2 → 2NO2, если объем газовой смеси уменьшить в три раза.
В два сосуда одной и той же вместимости введены: в первый – 1 моль газа А и 2 моля газа В, во второй – 2 моля газа А и 1 моль газа В. Температура в обоих сосудах одинакова. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением υ1 = k1[A][B]; б) уравнением υ2 = k2[A]2[B]? Объясните почему.
Вычислите, во сколько раз увеличится скорость химической реакции, протекающей в газовой фазе, если температуру повысить от 10 до 100⁰С? (Температурный коэффициент скорости реакции равен 2.)
Вычислите, как изменится скорость реакции при повышении температуры на 60ºС, если температурный коэффициент данной реакции ( γ ) равен 2.
