
- •Техника безопасности при работе в химической лаборатории.
- •Лабораторная химическая посуда.
- •2.2. Посуда специального назначения
- •2.3. Мерная посуда
- •2.4. Фарфоровая посуда
- •2.5. Подготовка стеклянной посуды к работе
- •Оформление лабораторной работы и записи в лабораторном журнале.
- •Классификация и номенклатура неорганических соединений
- •Тема 1 Основные законы и понятия химии. Понятие эквивалента. Определение эквивалента простого вещества и соединений.
- •Лабораторная работа 1 определение молярной массы эквивалента металла по водороду.
- •Тема 2. Классификация реактивов по степени чистоты. Методы очистки твердых веществ и газов.
- •Выбор растворителя.
- •Возгонка (сублимация).
- •Лабораторная работа №2 Очистка кристаллических веществ.
- •Экспериментальные и расчетные данные
- •Тема №3. Способы выражения концентрации растворов. Методы приготовления растворов.
- •Лабораторная работа №3 Получение насыщенного раствора соли. Приготовление растворов методом разбавления
- •Тема 4 Скорость химической реакции
- •Лабораторная работа 7. Определение константы скорости каталитического разложения пероксида водорода.
- •Лабораторная работа 8 Химическое равновесие Теоретическая часть
- •Тема 5 Буферные растворы
- •Расчет pH ацетатного буферного раствора
- •Расчет pH аммиачного буферного раствора
- •Определение буферной емкости
- •Лабораторная работа №9 Буферные растворы
- •Тема 6 Гидролиз
- •Лабораторная работа №10 Гидролиз соединений
- •Растворимость.
- •Гетерогенное равновесие в растворах электролитов.
- •Произведение растворимости.
- •Лабораторная работа №11 Гетерогенное равновесие в растворах электролитах. Произведение растворимости
- •Тема 8. Комплексные соединения
- •Комплексные соединения
- •Лабораторная работа №12. Комплексные соединения.
- •Тема 9 Окислительно-восстановительные процессы.
- •Лабораторная работа 13 окислительно-восстановительные реакции
- •Выполнение работы
- •Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция
- •Приложение.
Тема 1 Основные законы и понятия химии. Понятие эквивалента. Определение эквивалента простого вещества и соединений.
Важнейшие понятия: Моль. Молярная масса. Степень окисления. Типы (классы) химических соединений: оксиды, кислоты, основания, соли. Кислотность основания, основность кислоты. Типы химических реакций. Соли средние, кислые, основные. Стехиометрические законы. Уравнение Менделеева – Клайперона.
При теоретической подготовке к данному занятию следует особо обратить внимание на некоторые отличия современного представления об эквиваленте от принятого ранее и изложенного в больше учебных пособий. В соответствии с новым ГОСТом, принятым в 1978 г., предлагается следующее понятие эквивалента. В некоторых реакциях могут участвовать не все функциональные группы молекул, а только часть их, называемая эквивалентом.
Эквивалент есть 1/Z* часть частицы, где Z* - число эквивалентности. При Z*=1 эквивалент частицы соответствует самой частице. С понятием эквивалент связаны следующие величины:
Количество вещества эквивалента – n (1/Z*X) моль. Это такое количество вещества Х, которое соединяется с водородом количеством вещества 1 моль или замещает то же количество водорода в химических реакциях.
n(1/Z*X)= n (X)Z*,
где n (X) – количество вещества Х.
Молярная масса эквивалента Х – M (1/Z*X) г/ моль.
M (1/Z*X) = M(X)/Z*
Молярный объем эквивалента V (1/Z*X) л/ моль.
V (1/Z*X) = V (X)/Z*
Понятие эквивалента соединения употребляется только по отношению к конкретной химической реакции. Так, в реакциях ионного обмена число эквивалентности вещества соответствует произведению числа катионов (или анионов) этого соединения, участвующих в обмене на их заряд. Типичным примером реакции ионного обмена являются реакции нейтрализации, гидролиза. В них могут принимать участие разное число катионов (или анионов) одного соединения в случае многоосновных кислот и многокислотных оснований.
Н3РО4 + NaOH = NaH2PO4 + H2O Z* = 1
H3PO4 + 2NaOH = Na2HPO4+ 2H2O Z* = 2
H3PO4 + 3NaOH = Na3PO4 + 3H2O Z* = 3
NaH2PO4 + NaOH = Na2HPO4 Z* = 1
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O Z* = 2
NaH2PO4 + HCl = H3PO4 + NaCl Z*= 1
Молярная масса эквивалента дигидрофосфата натрия в соответствующих реакциях равна:
M (NaH2PO4) = 120 г/моль
M (1/2 NaH2PO4) = 60 г/моль
M (1/2 NaH2PO4) = 120 г/моль
M
(1/Z* соли) =
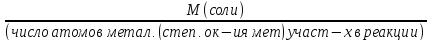
Определение эквивалента вещества в окислительно – восстановительных процессах. Элементарным процессом окисления (восстановления) можно считать процесс отдачи (или присоединения) электрона к атому водорода.
H – e = H+ (окисление)
H + e = H- (восстановление).
Так как эквивалент водорода равен 1 (Z* = 1), то эквивалент электрона тоже равен 1 (Z* = 1). Тогда в окислительно– восстановительных Z* окислителя или восстановителя определяется по числу электронов, участвующих в процессах восстановления или окисления соответственно.
Пример:
2KMnO4 +3H2SO4 + 5Na2SO3 = 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
Лабораторная работа 1 определение молярной массы эквивалента металла по водороду.
Цель работы: экспериментальное определение молярной массы эквивалента неизвестного металла. Определение металла- элемента.
Меры предосторожности при выполнении работы:
Работать со стеклом аккуратно, не применяя чрезмерных усилий!
Раствор кислоты приливать осторожно, пользуясь для этого мерным цилиндром с носиком.
Прибор для определения молярной массы эквивалента металла изображен на рис.1.
Он состоит из бюретки на 50 мл (1), двухколенной пробирки Оствальда (2), открытой трубки, служащей в качестве уравнительного сосуда (3), стеклянного крана (или зажима) (4). Для укрепления прибора используется штатив с держателями и зажимами.
Собрать прибор в соответствии с рис.1, в уравнительный сосуд налить воду, которая заполнит бюретку и вытеснит из прибора воздух через открытый кран (4). Бюретку укрепить на штативе так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением. Для удобства отсчета бюретку следует укрепить так, чтобы нулевое деление было на уровне глаз наблюдателя. Отсчеты уровня жидкости следует делать по нижнему краю мениска.
Получить навеску металла и поместить ее в одно из колен пробирки. В другое ее колено налить мерным цилиндром 24%-ый раствор соляной кислоты.
Прежде чем проводить реакции, следует убедиться в герметичности прибора (герметичность прибора – залог успеха опыта). Для этого плотно вставить пробки и закрыть кран тройника, уравнительный сосуд снять с держателя и опустить вниз на 15-20 см. Уровень воды в бюретке несколько снизится и остановится без изменения, если прибор герметичен. При возвращении сосуда на прежнее место вода в нем и в бюретке должна остаться на том же нулевом уровне.
После того как установлена герметичность прибора, пробирку следует повернуть таким образом, чтобы кислота перелилась в то колено пробирки, где находится металл. Если реакция протекает медленно, то можно подогреть реакционную пробирку, погружая ее в реакционный стакан с горячей водой.
Водород, выделившийся в результате взаимодействия металла с раствором кислоты, вытесняет из бюретки воду. Уравнительный сосуд при этом надо опускать и во время опыта стараться держать воду в нем и в бюретке на одном уровне, чтобы давление газа внутри прибора было все время близким к атмосферному.
Пока идет реакция, можно зарисовать в своей тетради установку, а также записать показания барометра – Р и термометра – 0С.
Когда весь металл растворится, понижение уровня воды в бюретке прекратится. Окончательный точный отсчет показаний на бюретке следует сделать после охлаждения пробирки до комнатной температуры.
Результаты измерений и расчетов оформить в виде таблицы.
Таблица 1
|
№ |
Данные опыта |
Номер опыта |
Масса навески металла, мг.
Атмосферное давление (по барометру) Ратм. (кПа).
Температура опыта, t0С.
Для приведения объема выделившегося водорода к нормальным условиям необходимо учесть, что водород, собранный над водой, содержит водяной пар и что общее давление газа в бюретке, равное атмосферному давлению, складывается из парциальных давлений водорода и водяного пара.
Таблица 2
Давление насыщенного водяного пара при различных температурах
|
Температура,С |
Давление, мм рт.ст. |
Температура,С |
Давление, мм рт.ст. |
|
16 |
13,63 |
21 |
18,65 |
|
17 |
14,43 |
22 |
19,83 |
|
18 |
15,48 |
23 |
21,07 |
|
19 |
16,48 |
24 |
22,38 |
|
20 |
17,54 |
25 |
23,76 |
Контрольные вопросы.
Масса 12 л газовой смеси (н. у.), состоящей из аммиака и углекислого газа, равна 18 г. Сколько литров каждого газа содержит смесь?
При разложении 21 г карбоната двухвалентного металла выделилось 5,6 л оксида углерода (IV) при н. у. Установите формулу соли.
При сгорании металла массой 3 г образуется его оксид массой 5,67 г. Валентность металла в оксиде равна 3. Что это за металл?
Вычислите объем, который займет при н. у. газовая смесь, содержащая водород массой 1,4 г и азот массой 5,6 г.
Газ массой 30,3 г заполнил сосуд вместимостью 15 л при температуре 18 °С. Давление газа внутри сосуда составляет 122 кПа. Рассчитайте молярную массу газа.
Определите число молекул газа, который заполняет сосуд вместимостью 190,4 л. Давление газа в сосуде равно 180 кПа, температура 37 °С.
Стеклянный сосуд, заполненный азотом, имеет массу 206,6 г; тот же сосуд, заполненный неизвестным газом, имеет массу 207,2 г. Масса сосуда, из которого откачаны газы, равна 202,4 г. Определите молярную массу неизвестного газа (азот и неизвестный газ находятся в сосуде при одинаковых условиях).
Массовая доля элемента X в его оксиде равна ω (77.46%). Вычислите молярную массу эквивалента элемента X. Определите элемент, если его валентность равна 2. Запишите формулу данного оксида.
При окислении металла массой 2.25 грамм образовался оксид металла массой, равной 6.25 грамм. Валентность металла в оксиде равна 2. Чему равна молярная масса эквивалента металла и его оксида? Какой это металл?
Массовая доля металла X в его хлориде равна ω (44.1%). Определите молярную массу эквивалента металла. Какой это металл, если его валентность равна 2? Запишите реакцию образования этого хлорида.
