
Физика-лекции
.pdf
атомы молекул водорода начинают колебаться, т.к. CV 72 R . Экспериментальная зависимость CV=f(T) объясняется квантовой теорией теплоемкостей.
§ 5. Адиабатический процесс
Процесс, происходящий при отсутствии теплообмена системы с окружающей средой, называется адиабатическим: dQ=0.
В реальных условиях процессом, близким к адиабатическому, является быстро протекающий процесс, например, быстрое сжатие газа в цилиндре с поршнем. Во время протекания адиабатического процесса система не успевает обменяться теплом с внешней средой.
Выведем уравнение адиабатического процесса. Применим первое начало термодинамики к адиабатическому процессу:
0 dU dA или 0 |
|
m |
|
i |
RdT pdV . |
|
|
|
|||||||||||||||||||||
M 2 |
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Продифференцируем уравнение состояния идеального газа |
pV |
m |
RT : |
||||||||||||||||||||||||||
M |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
pdV Vdp |
m |
RdT . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
pdV Vdp |
|
|
|
|
RdT |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
||||||
|
i m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
0 |
RdT pdV |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
2 |
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
i |
pdV Vdp pdV 0 , |
|
|
|
|
|
|
|||||||||||||||||||||
2 |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
i |
1 pdV |
i |
Vdp 0 . |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Умножим на R: |
|
i 2 |
R pdV |
i |
RVdp 0 , |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
p |
|
CV |
|
|
|
|||||||
C p pdV CV Vdp 0 .
Разделим на СV: |
C p |
pdV Vdp 0 . |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||||
|
CV |
|
|
|
|
|
|
|
|
|
|
||
Введем обозначение: |
C p |
|
i 2 |
|
- показатель адиабаты. |
||||||||
CV |
i |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||
pdV Vdp 0, |
|
pdV Vdp , |
|
dV |
|
dp |
. |
||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
V |
|
p |
||
61
Проинтегрируем:
V |
|
|
|
p |
|
2 |
|
||||
|
|
|
|
1 |
|
|
|
|
|||
|
|
|
|
p2 |
|
V1 |
|
|
|||
ln |
V2 |
ln |
p2 |
. |
|
||
|
|
|
|||||
|
V1 |
|
|
p1 |
|||
|
|
|
|
|
|||
или |
|
pV |
const |
. |
|||
|
|
|
p V |
|
|
p V |
T p V |
V |
|
V |
|
1 |
V |
|
1 |
|||||||||
|
С другой стороны: |
1 1 |
|
2 2 |
, |
1 |
|
1 1 |
|
|
2 |
|
|
|
2 |
|
|
|
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
T1 |
|
|
T2 |
T2 |
p2 V2 |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
V1 |
V1 |
|
V1 |
|
|||||||||||||||
или: |
TV 1 const |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аналогичным образом выводится третья форма |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
записи уравнения адиабаты: T p1 |
const . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
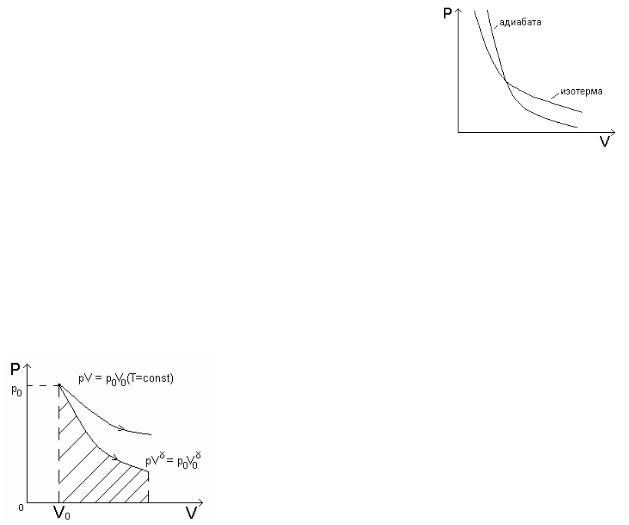
Все три уравнения - разные формы уравнения адиабаты или уравнения Пуассона.
Сравним адиабатический процесс и изотермический. Они похожи.
pV const - уравнение адиабаты, pV const - уравнение изотермы.
В изотермическом процессе давление p убывает обратно пропорционально объему V в первой степени. В адиабатическом процессе p убывает обратно
пропорционально V , где γ>1. Т.е. адиабата идет круче изотермы.
§ 6. Работа при адиабатическом расширении
Работа при адиабатическом процессе меньше, чем при изотермическом (см. на рисунке площадь под кривой), т.к. при адиабатическом расширении происходит охлаждение газа, а при изотермическом
– температура остается постоянной за счет притока извне количества теплоты.
Определим работу при адиабатическом расширении:
Из первого начала термодинамики для адиабатического процесса 0=dU+dA: dA=-dU.
|
Из |
|
определения молярной теплоемкости |
|||
|
dQ |
|
dU |
|
||
CV |
|
|
|
|
|
приращение внутренней энергии: |
|
|
|||||
|
dT V |
dT |
|
|||
при постоянном объеме
dU CV dT .
Для конечного процесса, когда расширяется газ массой m: U CV T . Тогда работа:
A СV T СV (T2 T1 ) СV (T1 T2 ) .
|
|
|
T |
|
Вынесем как общий множитель Т1: |
|
|
2 |
|
|
||||
A СV T1 1 |
T1 |
. |
||
|
|
|
|
62
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
V |
1 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Воспользуемся уравнением Пуассона: |
2 |
|
|
|
|
1 |
. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
V |
1 |
|
|
|
|
|
R |
|
V |
|
1 |
|
|
С RT |
|
V |
|
1 |
|||||||||||||||||||||||||
A С T 1 |
|
1 |
|
|
С T |
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
V |
1 |
1 |
1 |
|
. |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
V |
1 |
|
|
|
|
|
|
|
V 1 |
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
V2 |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С RT |
|
V |
|||||||
Воспользуемся уравнением Майера R C |
|
C |
|
: |
A |
|
|
|
V |
1 |
|
1 |
|
1 |
||||||||||||||||||||||||||||||||||||||
p |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
C p CV |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
V |
1 |
|
|
|
|||||||||
Поделим на СV числитель и знаменатель A |
|
|
|
|
|
|
1 |
|
1 |
|
1 |
|
. |
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C p |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СV |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Заменим |
|
C p |
. Тогда работа при адиабатическом процессе: |
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
CV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
RT |
|
|
V |
1 |
|
m |
RT |
|
|
|
V |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
A |
|
|
|
|
1 |
1 |
|
|
1 |
|
|
|
|
|
|
1 |
|
1 |
|
|
1 |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
1 |
|
|
|
|
|
M 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
V2 |
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
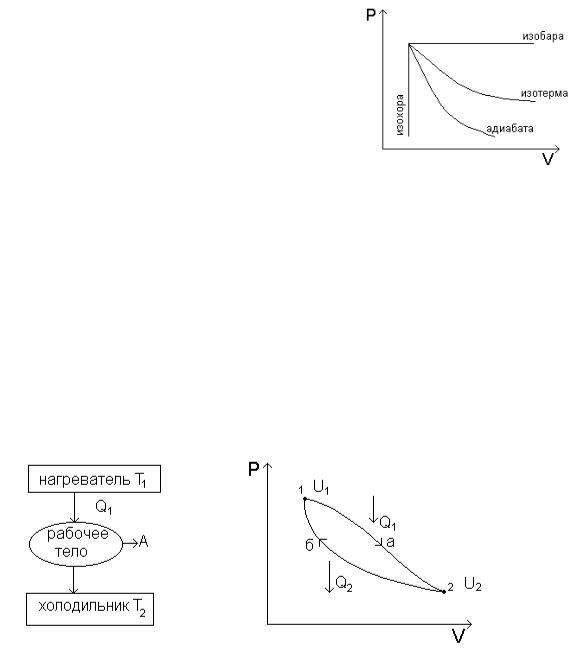
Изобразим все изопроцессы в координатах PV:
1 |
|
|
. |
|
|
|
|
|
|
§ 7. Тепловые двигатели, КПД
Термодинамика возникла как наука о превращении теплоты в работу. В задачу этой науки входило создание наиболее эффективных тепловых машин.
Тепловой машиной называется периодически действующий двигатель, совершающий работу за счет получаемого извне количества теплоты.
Основными частями теплового двигателя является: рабочее тело (например, газ в цилиндре под поршнем), нагреватель (горячее тело) и холодильник (холодное тело). Тепло Q1 передается рабочему телу от нагревателя, при этом газ расширяется. Затем тепло Q2 передается от рабочего тела к холодильнику, при этом газ сжимается.
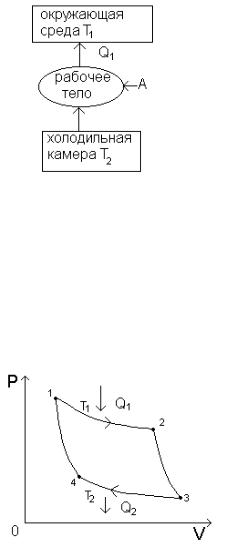
Запишем первое начало термодинамики для участков 1а2 и 2б1:
Q1 U 2 U1 A1 |
|
сложим эти уравнения: Q1 Q2 |
A1 A2 |
A. |
Q2 U1 U 2 |
|
|||
A2 |
|
|
|
Эффективность тепловой машины характеризуется коэффициентом полезного действия (КПД) η. КПД показывает, какая часть теплоты, полученной газом от нагревателя, превращается в механическую работу.
|
A |
|
Q1 Q2 |
1 |
Q2 |
|
. |
|
Q1 |
Q1 |
Q1 |
||||||
|
|
|
|
|||||
Из формулы видно, что η<1. Не все получаемое извне тепло используется для получения работы.
К тепловым машинам относятся: паровая машина η=18%; паровая турбина η=20%;
двигатель внутреннего сгорания η=35%.
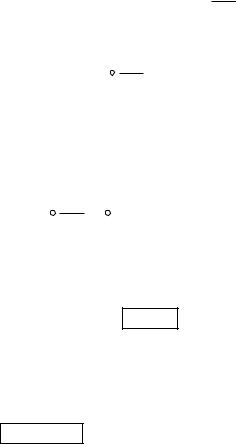
Холодильной машиной называется устройство, предназначенное для передачи тепла от менее нагретого тела (холодильной камеры) более горячему телу (окружающей среде). В этом случае используется обратный цикл. В обратном цикле газ (рабочее тело) отбирает теплоту у холодного тела. Затем, эта теплота вместе с теплотой, возникающей дополнительно при совершении работы над газом (работа компрессора), передается более горячему телу (окружающей среде).
§ 8. Цикл Карно
Французский инженер Сади Карно предложил цикл так называемой идеальной тепловой машины - цикл Карно, который является самым экономичным круговым обратимым процессом и состоит из двух изотерм и двух адиабат. Особенность цикла Карно: позволяет получить максимально возможную работу A за счет теплоты Q, взятой от нагревателя. В качестве рабочего тела в цикле Карно используется идеальный газ.
Рассчитаем КПД цикла Карно: |
A |
. |
||||||||||||||
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q1 |
|
Полезная работа за цикл равна сумме работ при |
||||||||||||||||
осуществлении отдельных частей цикла: |
|
|
||||||||||||||
|
|
|
|
A=A12+A23+A34+A41. |
|
|
||||||||||
1 2 изотермическое |
расширение |
T1=const, T=0, |
||||||||||||||
U12=0, |
Q A |
|
, A |
m |
|
RT ln |
V2 |
. |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||||
|
12 |
12 |
12 |
|
M |
|
|
V1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||
23 адиабатическое расширение Q |
0 , A |
|
U |
|
|
, |
A |
m |
|
С (T T ) . |
||||||
|
23 |
|
||||||||||||||
23 |
23 |
|
|
|
23 |
|
M |
V |
2 1 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
64

34 изотермическое сжатие T2=const, T=0, U34=0, Q |
A |
, |
A |
|
m |
|
RT ln |
V4 |
. |
|||||||
|
|
|||||||||||||||
|
|
|
|
|
34 |
34 |
34 |
|
M |
V3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
41 адиабатическое сжатие Q |
0 |
, A |
U |
|
, A |
m |
С (T T ) . |
|
|
|
||||||
41 |
|
|
|
|
||||||||||||
41 |
|
41 |
|
41 |
|
M |
V |
1 |
2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Количество теплоты, которое передается рабочему телу от нагревателя:
Q1 Q12 A12 m RT ln V2 . M V1
Количество теплоты, которое передается от рабочего тела к холодильнику:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q Q A |
m |
RT ln |
V4 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
34 |
|
|
|
|
|
|
|
|
34 |
|
|
|
M |
|
|
|
|
|
|
|
V3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Работы адиабатических участков равны по величине и противоположны по |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
знаку, поэтому: A23+A41=0. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
V |
|
|
|
V |
|
|
|
|
|
|
||||||
|
|
|
А A A |
A A A A |
|
|
R T ln |
|
2 |
T ln |
3 |
|
. |
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
12 |
34 |
|
|
|
23 |
|
|
|
|
|
41 |
|
|
|
|
|
|
12 |
|
|
|
34 |
|
|
M |
|
|
|
|
1 |
|
|
|
V1 |
|
|
2 |
V4 |
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
V4 |
|
|
|
|
|
|
|
V2 |
|
|
|
|
V4 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 ln |
|
|
|
|
|
|
|
T2 ln |
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
A12 A34 |
|
|
|
|
M |
R T1 ln |
|
V1 |
V3 |
|
|
|
|
T1 ln |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
V3 |
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|||||||||||||||||||||||||||||||||||||
|
Q |
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
RT1 ln |
V2 |
|
|
|
|
|
|
|
|
|
|
|
T1 ln |
V2 |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|||||||
Состояния 2 и 3 лежат на одной адиабате. Применим уравнение Пуассона: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
T |
|
|
|
|
V |
1 |
|
|
|
T V 1 |
T V 1 . |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
1 |
|
|
|
|
3 |
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
T |
|
|
|
|
|
V |
4 |
|
|
1 |
|
T V 1 |
T V 1 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
Аналогично для 4-1: |
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
T |
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
2 |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
2 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Отсюда: |
|
V2 |
|
V3 |
|
. Заменим в выражении для КПД: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
V1 |
|
|
|
|
V4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
T ln |
V2 |
T ln |
V3 |
|
|
T ln |
V2 |
|
T ln |
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
1 |
V1 |
|
|
|
|
2 |
|
|
V4 |
|
|
|
|
|
1 |
|
|
|
|
V1 |
|
|
|
2 |
|
|
|
|
|
V1 |
|
|
T1 T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 T2 |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
карно |
|
. |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
T1 ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|||||||||||||||||||||
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Отсюда вытекает, что для повышения КПД цикла Карно необходимо увеличивать разность температур нагревателя и холодильника, т.е. повышать температуру нагревателя и понижать температуру холодильника.
65
§ 9. Энтропия
Для идеальной машины, работающей по циклу Карно КПД можно рассчитать:
|
Q1 Q2 |
|
T1 T2 |
или 1 |
Q2 |
1 |
T2 |
или |
Q1 |
|
Q2 |
. |
|
Q1 |
|
T1 |
|
Q1 |
|
T1 |
|
T1 |
|
T2 |
|
Отношение количества переданной теплоты к температуре теплопередатчика или теплоприемника называется приведенной теплотой. Условились, что отданная теплоотдатчиком теплота Q1>0, а переданная теплоприемнику теплота Q2<0. Тогда для обратимого цикла Карно:
|
|
Q1 |
|
|
Q2 |
0 . |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||||
|
|
T1 |
T2 |
|
|
|
|
|
|
|||
Для необратимого цикла: |
Q1 Q2 |
|
|
T1 |
T2 |
, т.е. |
Q1 |
|
Q2 |
0 . |
||
|
|
|
|
|
|
|||||||
|
Q1 |
|
|
|
|
T1 |
|
|
T1 |
|
T2 |
|
Любой произвольный цикл можно разбить семействами изотерм и адиабат на совокупность ряда элементарных циклов Карно. Тогда приведенное количество
теплоты на бесконечно малом участке процесса dQT . Для всего цикла сумма
приведенных теплот:
dQT 0 .
Обозначим подынтегральное выражение как полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Называется эта функция состояния –
энтропией.
Для обратимых процессов: dQT dS 0 . Отсюда dS 0 , S const .
Для необратимого цикла dS>0.
В общем случае энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов): dS≥0. Для конечного процесса S 0 – это неравенство Клаудиуса.
Физический смысл энтропии был выяснен Л. Больцманом, предположившим, что энтропия связана с термодинамической вероятностью состояния системы. Термодинамическая вероятность W – это число способов, которыми может быть реализовано данное состояние макросистемы.
Формула Больцмана: S k ln W , где k – постоянная Больцмана.
Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Таким образом, можно сказать, что энтропия является мерой хаотичности (неупорядоченности) системы. Так энтропия жидкого тела больше энтропии тела в твердом состоянии; энтропия газа больше энтропии жидкости.
66

Все термодинамические процессы являются необратимыми, характеризуются направленностью. Например, самопроизвольное расширение газа в пустоту, самопроизвольный переход тепла от горячего тела к холодному и др. С молекулярно-кинетической точки зрения это объясняется тем, что такие процессы идут самопроизвольно из менее вероятного состояния в более вероятное, т.е. в сторону увеличения неупорядоченности системы. Энтропия является мерой неупорядоченности системы.
Первое начало термодинамики устанавливает количественное соотношение между Q, U, A. Второе начало термодинамики устанавливает направление и характер процессов, протекающих в природе.
Второе начало термодинамики можно сформулировать следующим образом: в изолированной системе все процессы самопроизвольно идут в сторону возрастания энтропии.
Т.о. второе начало термодинамики устанавливает стремление всех тел к наиболее вероятному состоянию. Однако применять его для нашей Вселенной нельзя, т.к. она незамкнута. Она обменивается теплотой с внешней средой. Если бы этот закон выполнялся для Вселенной, то это означало бы «тепловую смерть Вселенной». В природе осталась бы лишь одна форма движения материи – беспорядочное хаотическое движение молекул с одинаковой температурой всех тел.
Пусть система совершает равновесный переход из состояния 1 в состояние 2. Изменение энтропии:
S |
S S |
|
dQ |
|
|
dU dA |
. |
|
T |
|
|||||||
12 |
2 |
1 |
|
T |
||||
|
|
|
|
|
|
|||
Подынтегральное выражение и пределы интегрирования надо выразить через величины характеризующие процесс.
Энтропию определяют лишь с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропий.
|
Для идеального газа: dU |
m |
C dT , dA pdV |
m |
RT |
dV |
. |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
V |
|
|
|
|
|
|
|
M |
|
V |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
dQ |
|
|
dU dA |
|
|
dU |
|
|
dA m |
|
T2 |
dT |
|
m |
V2 |
dV |
|
m |
|
|
T |
|
m |
V |
|||||||||
|
|
T |
|
T |
|
T |
|
T M |
|
|
T |
|
M |
|
V M |
|
|
T M |
V |
|||||||||||||||||
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
R |
|
|
|
|
|
|
C ln |
2 |
|
|
R ln |
2 |
|
||
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
V |
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Для адиабатического |
процесса |
dQ=0, |
тогда |
S=0. |
Следовательно, |
S=const, |
т.е. |
|||||||||||||||||||||||||||||
адиабатический обратимый процесс протекает при постоянной энтропии. Его часто называют изоэнтропийным процессом.
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Этим свойством обладают: внутренняя энергия, масса, объем, в отличие от температуры, давления.
67
