
Физика-лекции
.pdf
|
|
|
|
|
|
dx Vdt |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Найдем проекцию скорости по определению: u |
|
|
dx |
|
|
|
1 2 |
|
|
dx Vdt |
. |
|||
x |
dt |
|
|
|
Vdx |
|
|
Vdx |
||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
dt |
|
|
dt |
|
||||||
|
|
|
|
|
c2 |
|
|
c2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 2 |
|
|
|
|
|
||
Поделим числитель и знаменатель правой части уравнения на dt , получим:
ux |
u |
V |
||
x |
|
|
. |
|
1 |
Vu |
|||
|
x |
|
||
|
c2 |
|||
Пусть для простоты материальная точка движется параллельно оси Х, тогда скорость относительно системы К совпадает с ее проекцией на ось Х. Тогда:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
u |
u V |
|
|
|
u V |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Vu , |
u |
|
Vu |
. |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
c2 |
|
|
|
|
||||||||||||
|
|
c2 |
|
|
|
|
|
|
|
|||||||||||||||
Эти уравнения носят название «релятивистский закон сложения |
||||||||||||||||||||||||
скоростей». |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если скорости V , u ,u малы по сравнению со скоростью c, то эти формулы |
||||||||||||||||||||||||
переходят в закон сложения скоростей в классической механике |
|
|
|
|
||||||||||||||||||||
u |
u V . |
|
||||||||||||||||||||||
Релятивистский закон сложения скоростей подчиняется второму постулату |
||||||||||||||||||||||||
Эйнштейна. Действительно, если: u с , то |
|
u |
c V |
c . |
|
Даже |
если |
|||||||||||||||||
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
Vc |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
c2 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
складываемые скорости сколь угодно близки к скорости света ( u V с ), |
то их |
|||||||||||||||||||||||
результирующая скорость всегда меньше или равна с (u |
c c |
|
c ). |
|
|
|||||||||||||||||||
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
cc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Таким образом, скорость света в вакууме есть предельная скорость, которую невозможно превысить.
§ 5. Основной закон релятивистской динамики материальной точки
Если частица движется со скоростью V, близкой к скорости света, то её масса зависит от скорости движения:
m |
|
m0 |
|
, |
|
|
|
|
|||
1 2 |
|||||
|
|
|
|||
где m0 – масса покоя частицы, т.е. масса, измеренная в той системе отсчета, относительно которой частица находится в покое; m – масса частицы в системе отсчета, относительно которой частица движется со скоростью V. Таким образом, масса одной и той же частицы различна в различных ИСО.
Принцип относительности Эйнштейна утверждает инвариантность всех законов природы при переходе от одной ИСО к другой.
41

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
dp |
|
|
d mV |
|
||||||||
Основной закон динамики Ньютона: F |
|
|
|
|
|
|
|
|
также инвариантен к |
||||||||
dt |
|
|
dt |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
преобразованиям Лоренца. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основной закон релятивистской динамики: |
|
|
|
|
|
|
|
|
|
|
|||||||
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
m V |
|
|
|
|
|
dp |
|
|
|
|
||||||
F |
|
|
0 |
|
|
|
|
|
|
|
|
, |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
1 |
2 |
dt |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
dt |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
m0V |
|
|
|||
где |
p mV |
|
|
|
|
- релятивистский импульс материальной точки. |
||
|
|
|
||||||
1 2 |
||||||||
|
|
|
|
|
|
|||
В силу однородности пространства в релятивистской механике выполняется
закон сохранения релятивистского импульса: релятивистский импульс замкнутой системы сохраняется.
§ 6. Закон взаимосвязи массы и энергии
Найдем кинетическую энергию релятивистской частицы.
Ранее было показано, что приращение кинетической энергии материальной точки на элементарном перемещении равно работе силы на этом перемещении:
|
|
|
|
|
|
|
|
|
|
|
dA dЕк |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Fdr . |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Подставляя значение силы, и учитывая dr |
Vdt , получим: |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
d |
m0V |
|
|
m0V |
|
|
|
|||||||||
|
|
|
|
dЕ |
|
|
|
|
|
|
Vdt Vd |
|
|
|
. |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
к |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
||
|
|
|
|
|
|
dt 1 |
|
|
|
|
|
1 |
|
|
|
|
||||||||
Применяя правила дифференцирования и учитывая |
|
|
|
VdV , приходим к |
||||||||||||||||||||
VdV |
||||||||||||||||||||||||
|
|
|
|
m0c |
2 |
|
|
|
c2dm , |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
выражению: dЕ |
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
1 V 2 c2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
т.е. приращение кинетической энергии частицы пропорционально приращению ее массы.
Так как кинетическая энергия покоящейся частицы равна нулю, а ее масса покоя m0, то проинтегрировав, получим:
Еk |
m |
m m0 |
c2 m . |
dЕ c2dm Ек c2 |
|||
0m0
АЭйнштейн обобщил положение о приращении кинетической энергии, предположив, что оно справедливо и для полной энергии: любое изменение массы сопровождается изменением полной энергии частицы:
E c2 m .
Отсюда А.Эйнштейн пришел к универсальной зависимости между полной энергией тела и его массой:
42

E mc2 |
|
m |
0 |
c2 |
|
|
|
. |
||
|
|
|
|
|
|
|
||||
1 |
2 |
|||||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Это уравнение выражает фундаментальный закон природы - закон взаимосвязи массы и энергии: полная энергия системы равна произведению её массы на квадрат скорости света в вакууме.
В полную энергию Е не входит потенциальная энергия частицы во внешнем
поле.
Учитывая выражение для кинетической энергии, запишем:
E m0c2 Ек .
Отсюда следует, что покоящееся тело обладает энергией:
E0 m0c2 ,
которая называется энергией покоя.
В силу однородности времени в релятивистской механике выполняется закон сохранения энергии: полная энергия замкнутой системы сохраняется.
Релятивистское соотношение между полной энергией и импульсом частицы:
E2 m2c4 m02c4 p2c2 или E 
 m02c4 p2c2 .
m02c4 p2c2 .
Закон взаимосвязи (пропорциональности) массы и энергии был блестяще подтвержден экспериментом о выделении энергии при протекании ядерных реакций.
Итак, основной вывод теории относительности сводится к тому, что пространство и время взаимосвязаны и образуют единую форму существования материи – пространство-время.
43

РАЗДЕЛ 2. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ Глава 2.1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
§1. Два метода исследования физических явлений
Внастоящее время в науке сложилось два метода изучения свойств макроскопических тел и протекающих в них процессов: статистический и термодинамический.
Согласно современным представлениям все тела состоят из мельчайших частиц: атомов, молекул, которые находятся в непрерывном хаотическом движении. Число атомов и молекул велико. В 1 см3 газа при нормальных условиях (н.у.) содержится 31019 молекул. Жидкие и твёрдые тела содержат в единице объема еще большее число молекул. Если считать, что движение молекул вещества подчиняется второму закону Ньютона, то не может быть и речи, что бы таким образом можно было определить положение и скорость молекулы, а значит состояние газа в какойто момент времени.
Кроме того, в огромной совокупности молекул возникают качественно новые закономерности, называемые статистическими.
Суть статистического метода: макроскопические свойства тел рассматриваются как проявление суммарного действия молекул. Определяется не поведение отдельных молекул, а средние величины, характеризующие движение и взаимодействие огромной совокупности частиц. Итак, статистическая физика – раздел физики, посвященный изучению свойств макроскопических тел, исходя из свойств образующих тело частиц и взаимодействий между ними.
Термодинамика – раздел физики, который изучает свойства макроскопических тел и протекающие в них процессы, не вдаваясь в микроскопическую природу тел. В основе термодинамики лежит небольшое число фундаментальных законов, установленных путем обобщения большого количества опытных фактов.
У статистической физики и термодинамики общий предмет изучения – свойства веществ и происходящие в них процессы. Подходя к изучению этих свойств и процессов с различных точек зрения, статистическая физика и термодинамика взаимно дополняют друг друга, образуя единое целое.
§2. Состояние термодинамической системы, параметры, процессы
Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией между собой и внешней средой.
Термодинамическая система может находиться в различных состояниях, отличающихся температурой Т, плотностью ρ, давлением p и т.д. Величины, характеризующие состояние системы, называются параметрами состояния.
Основные термодинамические параметры:
1. Удельный объем Vm – объем единицы массы. Если тело однородно ρ=const
часто используют в качестве основного параметра объем V – свойство тела занимать определенную часть пространства. [V]=м3.
44
2. Давление: p |
F |
- физическая величина, численно равная силе, |
|
S |
|||
|
|
действующей на единицу поверхности тела по направлению нормали к этой поверхности. Измеряется давление в системе СИ в паскалях. [p]=Па=Н/м2. Часто используются внесистемные единицы: 1атм (физическая)=760 мм.рт.ст.=1,01105 Па.
3. Температура – мера нагретости тел, величина, характеризующая среднюю кинетическую энергию поступательного движения молекул. Измеряется температура в системе СИ в кельвинах: [T]=К. В технике и в быту используется температура, отсчитанная по шкале Цельсия. Единица этой шкалы – градус Цельсия (ºС). Связь термодинамической температуры с температурой по шкале Цельсия:
Т=t+273,15.
Параметры состояния не всегда имеют определенные значения. Например, у тела, подогреваемого с одной стороны и охлаждаемого с другой, температура в разных точках будет различной, и телу нельзя приписать определенное значение температуры. Состояние, в котором хотя бы один из параметров не имеет определенного значения, называется неравновесным.
Состояние термодинамической системы будет равновесным, если все параметры состояния имеют во всех ее частях определенные значения, не изменяющиеся с течением времени.
Термодинамические системы, которые не обмениваются с внешней средой ни энергией, ни веществом называются изолированными или замкнутыми.
Термодинамическим процессом называется переход системы из одного состояния в другое или изменение состояния системы, связанное с изменением ее параметров.
Равновесным процессом называется процесс, состоящий из ряда следующих друг за другом равновесных состояний.
Равновесный процесс должен быть бесконечно медленным, чтобы в любой момент времени существовало равновесное состояние во всех частях системы.
§ 3. Понятия, модели, положения молекулярно-кинетической теории
Основные положения молекулярно-кинетической теории:
1)Все вещества состоят из огромного количества частиц. Наименьшая частица
вещества, сохраняющая его химические свойства, называется молекулой. Размеры молекул малы 10-8-10-9 см. Количество огромно: в 1 см3 газа при н.у. содержится приблизительно 31019 молекул. Явления, подтверждающие это положение - испарение, растворение, сжатие.
2)Все молекулы непрерывно и хаотично движутся. Хаотичность проявляется в том, что в газе любое направление движения молекул равновероятно. Явления, подтверждающие это положение - диффузия, броуновское движение.
3)Молекулы взаимодействуют между собой. Это происходит посредством молекулярных сил. На далеких расстояниях это силы притяжения, убывающие с увеличением расстояния; на близких – силы отталкивания, быстро возрастающие
45

при сближении молекул. Доказательство этого положения – твердые тела сохраняют свою форму и объем.
Основные понятия молекулярно-кинетической теории:
1.Относительная атомная масса химического элемента Аr – отношение массы атома этого элемента к 1/12 массы атома изотопа углерода 12С. Находится из таблицы химических элементов Менделеева. Например, Аr(16O8)=16. Относительная
молекулярная масса вещества Mr - отношение массы молекулы этого вещества к 1/12 массы атома изотопа углерода 12С.
2.Моль – количество вещества, в котором содержится количество частиц равное числу атомов в 12 г изотопа углерода 12С.
3.Постоянная Авогадро – число частиц в одном моле вещества NA=6,02 1023 моль-1.
4.Молярная масса – масса одного моля вещества М=10-3 Mr (кг/моль).
5. |
Число молей вещества: |
m |
|
|
N |
. |
|
|
||
|
|
|
|
|
||||||
|
|
M |
|
|
N A |
|
|
|||
6. |
Газовая постоянная R=8,31 Дж/(моль К) |
|
|
|||||||
7. |
Постоянная Больцмана – доля газовой постоянной, приходящейся на 1 молекулу: |
|||||||||
|
|
k |
|
R |
, k=1,38 10-23 Дж/К. |
|||||
|
|
|
|
|||||||
|
|
|
|
|
N A |
|
|
|||
8. |
Нормальные условия (н.у.): |
|
температура |
273 К=0 С; |
||||||
|
|
|
|
|
давление: |
1 атм=105 Па. |
||||
9. |
Объем одного моля любого газа при н.у. по закону Авогадро равен 22,4 л. |
|||||||||
10.Идеальный газ - газ взаимодействием |
между |
молекулами которого можно |
||||||||
|
пренебречь. |
|
|
|
|
|
|
|
||
§ 4. Уравнение состояния идеального газа
Параметры состояния p,V,T системы связаны друг с другом. Соотношение, определяющее связь между параметрами состояния какого-либо тела, называется
уравнением состояния этого тела.
Опытным путем было установлено, что при обычных условиях параметры состояния таких газов как кислород O2, азот N2 подчиняются уравнению:
pV b , T
где b – константа, пропорциональная массе газа.
Оказалось, что чем разреженнее газ, тем точнее выполняется это уравнение. Газ, взаимодействием между молекулами которого можно пренебречь, был назван идеальным. Такой газ строго подчиняется уравнению состояния. Особенно близки по свойствам к идеальному газу гелий и водород.
Согласно закону Авогадро при н.у. объем одного моля любого газа одинаков: 22,4 л. Отсюда следует, что если количество газа один моль, то константа в уравнении состояния будет одинаковой для всех газов и равной:
46

|
p V |
|
1,013 105 22,4 10 |
3 |
|
b |
0 M |
|
|
|
8,31 Дж/(моль К). |
T0 |
273 |
|
|||
|
|
|
|
||
Эту константу обозначили R и назвали молярной газовой постоянной или просто газовой постоянной.
Тогда уравнение состояния ИГ для 1 моля: pVM RT .
Для произвольной массы газа m умножим обе части равенства на число молей
. Общий объем газа: V V |
|
|
|
m |
V |
|
. Тогда уравнение состояния ИГ массы m: |
||||||||||||
M |
M |
M |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
pV |
|
m |
RT |
. |
|
(1) |
||||||
|
|
|
|
|
|
|
|
M |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Преобразуем это уравнение: |
|
|
|
|
|
|
|||||||||||||
pV |
m |
RT |
N A |
|
m |
N |
|
|
|
R |
T N |
|
kT NkT . Таким образом: |
||||||
|
|
|
A |
|
|
|
A |
||||||||||||
|
M N A |
|
M |
|
N A |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
pV NkT |
. |
|
|
(2) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Разделим обе части уравнения на объем и используем понятие концентрации:
n |
N |
. |
|
|
|
|
|
|
|
|
|
|
|||
|
V |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
p |
N |
kT nkT |
. |
(3) |
|
|
|
|||||
|
|
|
|
V |
|
|
|
|
Уравненияя (1,2,3) – различные формы записи уравнения состояния |
||||||
идеального газа. |
|
|
|
|
|||
Переход системы из состояния 1 с параметрами (p1, V1, T1) в состояние 2 с параметрами (p2, V2, T2) можно описать уравнением перехода:
p1V1 p2V2 . T1 T2
§ 5. Опытные законы идеального газа
Опытным путем, задолго до появления молекулярно-кинетической теории были открыты законы, описывающие поведение ИГ при изопроцессах.
Изопроцессы – процессы, протекающие при одном неизменном параметре. 1) Закон Бойля-Мариотта для изотермического процесса:
Для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная
pV const при T=const, m=const.
При постоянной температуре T=const давление обратно пропорционально объему: р~ V1 .
47
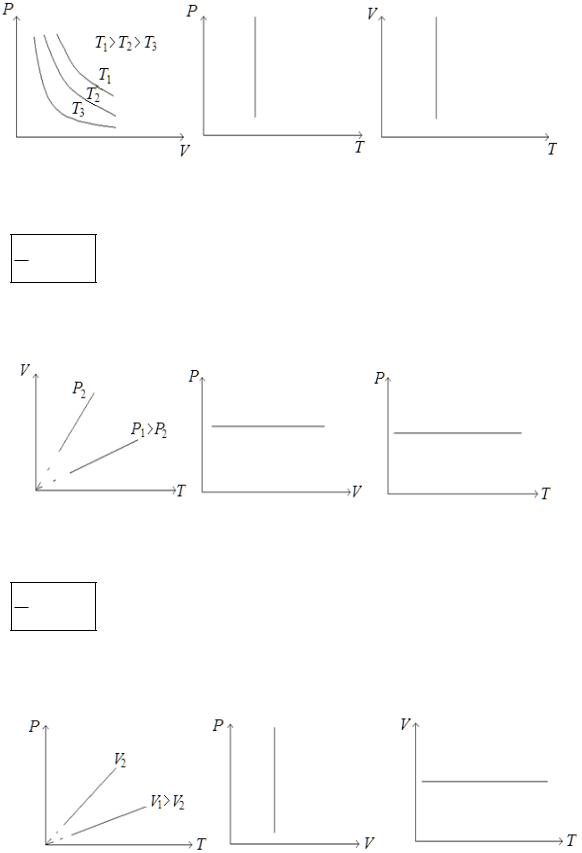
График зависимости p f (V ) – изотерма. В координатах pV изотерма изображается гиперболой.
2) Закон Гей-Люссака для изобарного процесса:
Объем данной массы газа при постоянном давлении изменяется линейно с температурой
VT const, при р=const, m=const.
При постоянном давлении р=const объем прямо пропорционален температуре: V~T.
График зависимости V f (T ) – изобара.
3) Закон Шарля для изохорного процесса.
Давление данной массы газа при постоянном объеме изменяется линейно с температурой.
Tp const, при V=const, m=const.
При постоянном объеме V=const давление прямо пропорционально температуре: p~T.
График зависимости p f (T ) – изохора.
48
§ 6. Основное уравнение молекулярно-кинетической теории
При движении молекулы газа ударяют о стенку сосуда, создавая давление. Рассчитаем давление газа на стенку сосуда.
Для этого сделаем следующие предположения:
1)давление на стенку не зависит от формы сосуда;
2)ударяющиеся молекулы отражаются от стенки без изменения модуля скорости;
3)если газ находится в равновесии, то все направления движения молекул равновероятны (хаотичность движения).
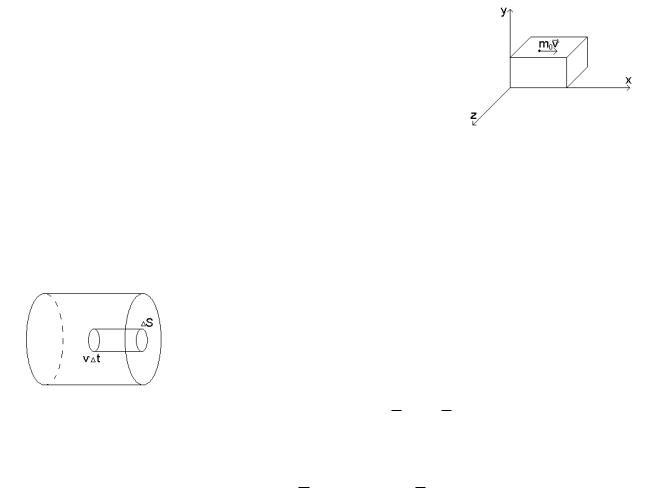
Пусть сосуд имеет форму прямоугольного параллелепипеда. Всего в сосуде N молекул. Используем координаты (x,y,z). Вдоль одной оси X движется N/3 молекул, причем половина этого числа
движется в одну сторону, половина в противоположную. Таким образом, в одном направлении к площадке движется N/6 молекул. Молекула массы m0 движется со скоростью V. Изменение импульса молекулы вследствие удара:
|
|
|
|
|
|
|
|
p p2 |
p1 |
m0V2 |
m0V1 |
(V2 |
V1 ) 2m0V . |
||
Таким образом, одна молекула газа передает стенке импульс: 2m0V.
Выберем площадку ∆S, о которую ударяются молекулы за время ∆t. О стенку ударяются лишь те молекулы, которые в начальный момент времени были не дальше, чем на расстояние V ∆t от стенки. Тогда число ударов N/6 молекул о площадку ∆S можно представить:
16 N 16 n S V t .
Все ударяющиеся молекулы передадут стенке импульс за ∆t:p 2m0V 16 n S V t 13 m0V 2 n S t .
По второму закону Ньютона: |
p F , |
по определению давления: p |
F |
. |
||||||||||||
|
||||||||||||||||
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
S |
|
Тогда: p |
F |
p |
1 |
|
1 |
m V 2 n S t |
1 |
|
|
1 |
m V 2 n . |
|
|
|||
|
|
|
|
|
|
|
|
|||||||||
|
S |
t |
S 3 |
0 |
|
t S 3 |
0 |
|
|
|||||||
|
|
|
|
|
|
|||||||||||
Т. к. молекул очень много и не все они имеют скорость V, то в последнем выражении надо взять среднюю скорость движения молекул <V>. Тогда окончательно основное уравнение МКТ:
p |
1 |
m n V 2 |
, |
|
|||
|
3 |
0 |
|
|
|
|
где n – концентрация молекул, m0 – масса одной молекулы данного газа, ‹V› - средняя скорость движения молекул газа.
Это уравнение связывает макропараметр газа – давление, с микропараметрами - массой одной молекулы, средней скоростью молекулы.
49

§ 7. Средняя кинетическая энергия молекул идеального газа
Молекулы газа находятся в непрерывном движении, следовательно, они обладают кинетической энергией. Поскольку молекул газа огромное число, имеет смысл говорить о средней скорости движения молекул ‹V› и средней кинетической энергии ‹Ек› молекул.
По определению кинетическая энергия: E |
|
|
m V 2 |
|
|
|||||||||||||
k |
|
|
|
|
|
. |
|
|
||||||||||
|
|
2 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Преобразуем основное уравнение МКТ: |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
1 |
m n V 2 |
|
2 |
|
2 |
|
m V 2 |
|
2 |
|
|
|
|
||||
p |
|
|
|
|
|
n |
0 |
|
|
|
|
|
|
n E |
|
. |
||
|
|
|
|
|
|
|
|
|
k |
|||||||||
|
3 |
0 |
|
2 |
|
3 |
|
|
|
2 |
|
|
3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Используем уравнение состояния ИГ: p nkT .
Сравним эти выражения: 23 n Ek nkT . Отсюда средняя кинетическая энергия поступательного движения молекул ИГ:
Ek 23 kT .
Как видим, Ek т зависит только от термодинамической температуры.
Из этой формулы вытекает молекулярно-кинетическое толкование температуры.
Абсолютная температура – это физическая величина, характеризующая состояние термодинамического равновесия и равная с точностью до постоянного множителя средней кинетической энергии поступательного движения молекул идеального газа.
Из формулы следует, что при абсолютном нуле температуры средняя кинетическая энергия ‹Еk› должна быть равна нулю, но это неправомерно, т.к. по мере приближения к абсолютному нулю идеальный газ превращается в реальный, затем в жидкость и твердое тело. А это уравнение справедливо только для идеального газа. При абсолютном нуле колебания молекул не прекращаются, следовательно, состояние абсолютного нуля следует рассматривать как состояние с минимальным значением энергии.
Выразим среднюю квадратичную скорость молекул газа.
|
|
|
m V 2 |
|
|
|
|
|
|
|
3 |
|
|
m0 |
V 2 |
3 |
|
|||||||||
С одной стороны: |
Ek |
|
|
|
, с другой: Ek |
|
|
|
|
|
kT ; |
|
|
|
|
kT . |
||||||||||
2 |
|
|
2 |
|
2 |
2 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Отсюда средняя квадратичная скорость молекул газа: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
V |
3kT |
|
|
3T |
|
R |
|
|
3RT |
|
. |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
m0 |
m0 |
N A |
M |
|
|
|
|
|
|
|
|
|
|
||||||||
50
