
бх7
.docx1
A. АЛК
B. инозиновой кислоты
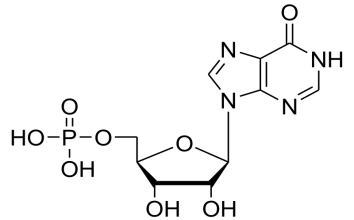
Биологически важными производными инозиновой кислоты являются пуриновые нуклеотиды, входящие в состав нуклеиновых кислот, а также АТФ, который служит для сохранения химической энергии в клетках.
В пищевой промышленности соли инозиновой кислоты используются как усилители вкуса (пищевая добавка E630).
C. биливердин
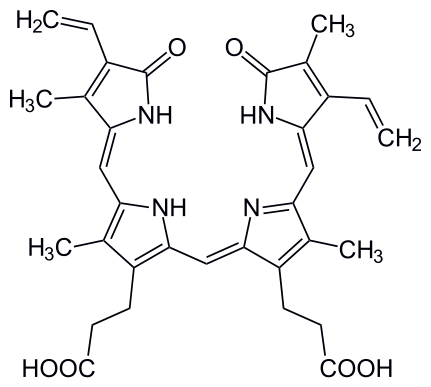
Биливердин является промежуточным продуктом распада гемоглобина, который происходит в клетках системы макрофагов печени, костного мозга и селезёнки. При его распаде также высвобождается белокглобин и железо. Под действием ферментов биливердин восстанавливается до билирубина.
D. оротовая кислота
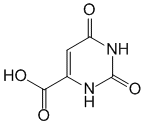
Оротовая кислота принимает участие в обменных процессах, происходящих в белках и фосфолипидах, в превращениях фолиевой ипантотеновой кислот, в метаболизме цианокобаламина (витамин B12), синтезе аминокислоты метионина. Является предшественником в биосинтезе пиримидиновых оснований, участвуя в образовании пиримидиновых нуклеотидов — уридинмонофосфата и цитидинмонофосфата)
2
А. изофермент лдг
Основное значение определения активности ЛДГ-1 - диагностика инфаркта миокарда. Повышение активности ЛДГ-1 в течение первых трех суток после появления болей позволяет с большой вероятностью диагностировать инфаркт миокарда или исключить этот диагноз. Через 16-20 часов после болевого приступа, когда общая активность ЛДГ еще не выходит за пределы референсных значений, наблюдается рост ЛДГ-1. Активность ЛДГ-1 может оставаться увеличенной после того, как суммарная активность ЛДГ сыворотки уже возвращается к норме. При небольших инфарктах активность ЛДГ-1 может быть увеличенной, в то время как общая ЛДГ остается в пределах нормы.
Повышение активности ЛДГ-1 (и ЛДГ-2) наблюдается при мегалобластных анемиях. При злокачественных заболеваниях изоферментный состав ЛДГ иногда связан с локализацией поражения, но чаще наблюдается неспецифическое увеличение элект-рофоретически медленных форм - ЛДГ 4 и 5 (исключением является заметное повышение концентрации ЛДГ-1 при опухолях герминативной ткани).
B. непрямой билирубин
Исследование непрямого билирубина играет важнейшую роль в диагностике гемолитических анемий. В норме в крови 75% общего билирубина приходится на долю непрямого (свободного) билирубина и 25% на долю прямого (связанного) билирубина.
Содержание непрямого билирубина повышается при гемолитических анемиях, пернициозной анемии, при желтухе новорождённых, синдромах Жильбера, Криглера-Найяра, Ротора. Повышение концентрации непрямого билирубина при гемолитической анемии обусловлено интенсивным образованием его вследствие гемолиза эритроцитов, и печень оказывается неспособной к образованию столь большого количества глюкуронидов билирубина. При перечисленных синдромах нарушена конъюгация непрямого билирубина с глюкуроновой кислотой.
C. изоферменты креатинфосфокиназы
Исследование активности изоферментов КФК в сыворотке крови имеет важное диагностическое значение. Изоферменты креатинкиназы особо важно исследовать при остром инфаркте миокарда, так как МВ-форма в значительном количестве содержится практически только в сердечной мышце. Повышение активности МВ-формы в сыворотке крови свидетельствует о поражении именно сердечной мышцы.
Возрастание активности ферментов сыворотки крови при многих патологических процессах объясняется, прежде всего, двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося их биосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих в кровь. Возможно, что повышение активности ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществ связано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов
D. АлАт, и АсАт
И АлАт, и АсАт относятся к ферментам – аминотрансферазам. Эти ферменты наиболее активные во всем организме любого человека. Больше всего АлАта в печени, а АсАта – в тканях мышц, особенно – в тканях миокарда, сердечной мышцы. АсАт состоит из цитоплазматического изофермента и митохондриального изофермента. 80% всей активности АсАта приходится именно на цитоплазматический изофермент. В сыворотке крови из двух этих изоферментов обычно определяется только цитоплазматический-
3
A. поражение почечного фильтра – повышение проницаемости гломерул (нарушение эндотелия, базальной мембраны, дефект подоцитов),
- снижение кровотока в почках (замедление, уменьшение объема крови).
Внепочечные протеинурии:
- данный вид протеинурия возникает при воспалении в мочеточниках, мочевом пузыре, уретре, предстательной железе,
- также в моче определяют белок Бенс-Джонса, что характерно для миеломной болезни, макроглобулинемии Вальденстрема.
B. ферменты определяемые при инфаркте миокарда
Для диагностики инфаркта миокарда важно определение активности прежде всего следующих ферментов: креатин-фосфокиназы (КФК), глютамат-оксалацетат-трансаминазы (ГОТ), глютамат-пируват-трансаминазы (ГПТ), лактатдегидрокиназы (ЛДГ).
C. последствия возможных нарушений обмена тирозина
Нарушение обмена тирозина выявляют при заболеваниях почек и печени, меланоме, алкоголизме, а также при наследственной патологии (алкаптонурия, тирозиноз, альбинизм). Симптомы нарушения обмена тирозина зависят от его степени и от характера заболевания, которое это нарушение вызывает.
D. продукты распада гема
Первая реакция распада гемоглобина – это гидролиз его белковой части.
Катаболизм гема, освобождение от белковой части происходит в микросомальной фракции при участии сложной гем-оксигеназной ферментативной системы, требующей наличие НАДФН2 и кислорода. При поступлении гема в гемаксиназную систему микросом ионы железа окисляются в ферри форму, т.е. гем превращается в гемин.
гем (Fe2+)® (над: оксигеназа) гемин(Fe3+) (это ферри форма) ® (над: редуктаза; под: НАДФH2®НАДФ) гемин (Fe2+) (ферро форма) ® (над: редуктаза, +О2; под: НАДФН2®НАДФ)оксигемин (Fe3+)® (над: редуктаза, +О2; под: -СО, -Fe3+)биливердин® ( над: НАДФН2®НАДФ) ®билирубин® (над: +альбумин) билирубин-альбумин (неконъюгированный билирубин - НБ).
4
A Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Энзимодиагностика-развивается по двум путям.
Один путь-использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых).
B Энзимотерапия,
Энзимотерапия – применение ферментов животного, бактериального или растительного происхождения и регуляторов активности ферментов с лечебной целью.
Внедрению ферментных препаратов в современную клиническую практику способствовало развитие технологий получения обогащенных ферментами препаратов и очищенных ферментов.
C Лекарственные препараты на основе ферментов. В качестве лекарственных препаратов наиболее широко используются протеолитические ферменты.
1). Протеолитические ферменты применяются при нарушении пищеварения. Например:
а). Экстракты слизистой оболочки желудка, основным действующим веществом которых является пепсин. Это препараты абомин иацидинпепсин, их в основном используют для коррекции секреторной дисфункции желудка.
б). Панкреатические энзимы, представленные амилазой, липазой, трипсином и химотрипсином. Это препараты панкреатин, мезим-форте, панцитрат, креон, их используются для коррекции нарушений процесса пищеварения, а также для регуляции функций поджелудочной железы.
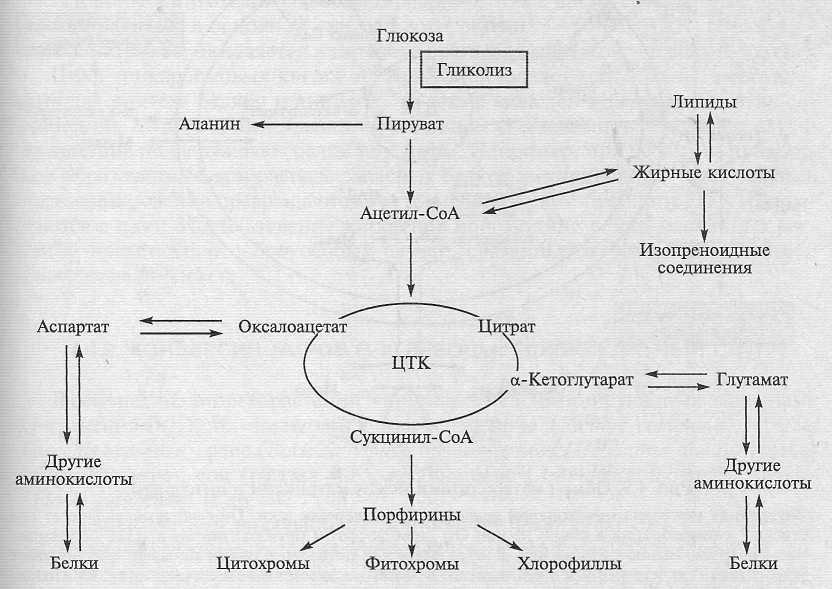
5 A/d/ c /b
6
