
Міністерство освіти і науки України
.docxМіністерство освіти і науки України
Національний технічний університет України “Київський політехничнічний інститут”
Реферат
з курсу «Інженерне матеріалознавство»
на тему:
«Кристалічна будова та властивості рубідію»
Виконав:
Студент 2-го курсу
ІФФ (гр. ФК-12)
Слєпкін Олексій.
Перевірив:
Дудка О.І.
Київ 2013
План:
1. Історія відкриття рубідію..…………………………………………………….3
2. Застосування…………………………………………………………………....5
3. Властивості…………..………………………………………………………….7
4. Спосіб добування рубідію.……………..……………………………..……….9
5. Кристалічна будова рубідію…...…………………………………………..…10
6. Список використаної літератури……………………………………………..12
Історія відкриття рубідію
Рубідій є одним з елементів, відкритим з використанням спектрального аналізу. Елемент був відкритий при вивченні мінералу лепідоліту. Першим детально проаналізував склад мінералу М.Клапорт. Це сталося наприкінці XVIII сторіччя. Він шукав присутність лугів у леподоліте. Засумнівавшись у своїх результатах, Клапорт провів повторний, більш ретельний аналіз. Він отримав такий результат: 54,5%-оксид кремнію, 38,25% - оксид алюмінію, 4% - оксид калію і 0,75% - оксид марганцю. Залишок у 2,5%-Клапорт відніс до води, яка випарувалася в процесі розкладання мінералу. Але склад таки залишився нерозпізнаним. Ним не були розпізнані літій і фтор, які є складовою частиною лепідоліту. У 1861 році Р. Бунзен і Г. Кірхгофф виділили з мінералу компоненти лужних металів, калій був осаджений хлороплатинат калію, який був підданий ретельній промивці. Що залишився осад був проаналізований спектроскопічно.І 23 лютого вчені-хіміки виступили на засіданні Академії наук у Берліні з повідомленням про відкриття нового лужного металу, який у спектрі виділявся лінією темно-червоного кольору. Вони дали йому назву рубідій, що в перекладі означає червоний. Вперше метал у чистому вигляді був виділений Р.Бунзеном в 1863 році.
Застосування
Застосовують також у виробництві фотоелементів, у лампах денного світла, як каталізатор. Прогнозна потреба в ньому до 2000 р. незначна — приблизно 3 т. Рубідій використовується в обмеженій кількості в медицині, аналітичній хімії. Рубідій використовується не тільки в чистому вигляді, але і у вигляді ряду сплавів і хімічних сполук. Рубідій має хорошу сировинну базу, більш сприятливу, ніж для цезію. Область застосування рубідію у зв'язку зі зростанням його доступності розширюється. Ізотоп рубідій-86 широко використовується в гамма-дефектоскопії, вимірювальної техніки, а також при стерилізації ліків і харчових продуктів. Рубідій і його сплави з цезієм - це дуже перспективний теплоносій і робоче середовище для високотемпературних турбоагрегатів (у цьому зв'язку рубідій і цезій в останні роки придбали важливе значення, і надзвичайна дорожнеча металів йде на другий план по відношенню до можливостей різко збільшити ККД турбоагрегатів, а значить і знизити витрати палива і забруднення навколишнього середовища). Застосовувані найбільш широко в якості теплоносіїв системи на основі рубідію - це потрійні сплави: натрій - калій -рубідій, і натрій-рубідій- цезій. В каталізі рубідій використовується як в органічному, так і неорганічний синтезі. Каталітична активність рубідію використовується в основному для переробки нафти на ряд важливих продуктів. Ацетат рубідію, наприклад, використовується для синтезу метанолу і цілого ряду вищих спиртів з водяного газу, що актуально у зв'язку з підземною газифікацією вугілля та у виробництві штучного рідкого палива для автомобілів і реактивного палива. Ряд сплавів рубідію з телуром володіють вищою чутливістю в ультрафіолетовій області спектра, ніж сполуки цезію, і в зв'язку з цим він здатний в цьому випадку скласти конкуренцію цезію як матеріал для фотоперетворювачів. У складі спеціальних мастильних композицій (сплавів), рубідій застосовується як високоефективна змазка у вакуумі (ракетна та космічна техніка). Гідроксид рубідію застосовується для приготування електроліту для низькотемпературних хімічних джерел струму, а також в якості добавки до розчину гідроксиду калію для поліпшення його працездатності при низьких температурах і підвищення електропровідності електроліту. У гідридних паливних елементах знаходить застосування металевий рубідій. Хлорид рубідію в сплаві з хлоридом міді знаходить застосування для вимірювання високих температур (до 400 C). Пари рубідію використовуються як робоче тіло в лазерах, зокрема, в рубідієвий атомних годинниках. Хлорид рубідію застосовується в паливних елементах в якості електроліту, те саме можна сказати і про гідроксиді рубідію, який дуже ефективний як електроліт в паливних елементах, що використовують пряме окислення вугілля.
Властивості рубідію
Рубідій (лат. Rubidium), Rb, хімічний елемент I групи періодичної системи Менделєєва, атомний номер 37, атомна маса 85,4678. Відноситься до лужним металів.
Властивості: сріблясто-білий метал пастоподібної консистенції. Щільність 1,5248 г/см3, tпл39, 5 ° С, tкіп 685 ° С. На повітрі миттєво запалюється, з водою реагує з вибухом.
Хімічні властивості:
Рубідій є сильним відновлювачем.
Енергійно взаємодіють з багатьма неметалами:
2Rb + Сl2 = 2RbСl (хлорид заліза)
2Rb + S = Rb2S (сульфід заліза)
2Rb + Н2 = 2RbH (гідрид рубідію)
Рубідій активно взаємодіє з водою:
2Rb + 2H2O = 2RbOH + H2
Розчиняється майже в усіх кислотах з утворенням великої кількості солей:
2Rb + 2НСl = 2RbСl + Н2
Назва: від латинського "rubidus" (темно-червоний), відкритий по лініях у червоній частини спектру.
Знаходження в природі: у природі неуважний, супроводжує калію (K) літію (Li) і видобувається з їх мінералів.
Застосування: застосовується обмежено (катоди для фотоелементів, добавка в газорозрядні трубки, каталізатор в органічному синтезі).
Загальні відомості в табличній формі
|
Атомний номер |
37 |
|
Зовнішній вигляд простої речовини |
м'ягкий, сріблясто-білий, хімічно-активний метал |
Властивості атома
|
Атомна маса (молярна маса) |
85,4678 а.о.м. (г/моль) |
|
Радіус атома |
248 пм |
|
Енергія йонізації (перший електрон) |
402,8(4,17) кДж/моль (еВ) |
|
Електронна конфігурація |
[Kr] 5s1 |
Хімічні властивості
|
Ковалентний радіус |
216 пм |
|
Радіус йона |
(+1e)147 пм |
|
Електронегативність (за Полінгом) |
0.82 |
|
Електродний потенціал |
0 |
|
Ступені окиснення |
1 |
Термодинамічні властивості
|
Густина |
1,532 г/см³ |
|
Питома теплоємність |
0.360 Дж/(K моль) |
|
Теплопровідність |
58.2 Вт/(м К) |
|
Температура плавлення |
312.2 K |
|
Теплота плавлення |
2.20 кДж/моль |
|
Температура кипіння |
961K |
|
Теплота випаровування |
75.8 кДж/моль |
|
Молярний об'єм |
55.9 см³/моль |
Спосіб добування рубідію
Більшу частину видобутого рубідію отримують як побічний продукт при виробництві літію з лепідолітом. Після виділення літію у вигляді карбонату абогідроксиду рубідій облогу з маткових розчинів у вигляді суміші алюморубідіевих, алюмокалієвого і алюмоцезіевих квасцов RbAl (SO 4) 2 12H 2 O, KAl (SO 4) 2.12 H 2 O, CsAl (SO 4) 2 12H 2 O. Суміш розділяють багаторазової перекристалізацією.
Рубідій також виділяють і з відпрацьованого електроліту, що виходить при отриманні магнію з карналіту. З нього рубідій виділяють сорбцією на опадах фероціанідів заліза або нікелю. Потім фероціаніди прожарюють і отримують карбонат рубідію з домішками калію і цезію. При отриманні цезію з поллуцита рубідій витягують з маткових розчинів після осадження Cs 3 [Sb 2 Cl 9]. Можна витягати рубідій і з технологічних розчинів, що утворюються при отриманні глинозему знефеліну.
Для витягання рубідію використовують методи екстракції та іонообмінної хроматографії. З'єднання рубідію високої чистоти отримують з використанням полігалогенідов.
Значну частину виробленого рубідію виділяють в ході отримання літію, тому поява великого інтересу до літію для використання його в термоядерних процесах в 1950-х призвело до збільшення видобутку літію, а, отже, і рубідію. Саме тому з'єднання рубідію стали більш доступними.
Кристалічна будова
Як
вже зазначалося раніше, рубідій має
об’ємоцентровану кубічну гратку з
періодом при t
= 250C
(а = 5,590 
 ;
С = 5,2002
;
С = 5,2002 
 ).
Вона утворюється тоді, коли іони
розміщуються не тільки у вершинах куба,
а й у його центрі.
).
Вона утворюється тоді, коли іони
розміщуються не тільки у вершинах куба,
а й у його центрі.
Координаційне число
Це
кількість найближчих рівновідаленних
сусідів у кожної частинки. ОЦК-гратка
є менш компактною, ніж ГЦК-гратка. Кожен
з її іонів має тільки 8 сусідів (рис.1) та
ще й найбільшій відстані, яка дорівнює
а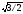 =0,866
а.
Отже, її координаційне число становить
8, а гратку позначають ще К8.
=0,866
а.
Отже, її координаційне число становить
8, а гратку позначають ще К8.
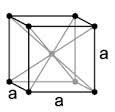
Рис.1.Схема визначення координаційного числа
Щільність пакування
Це
кількість іонів, що припадають на
елементарну комірку. В ОЦК – гратці 8
іонів, які розташовані у вершинах куба,
належать водночас 8 коміркам і ще
додається 1 іон, який розташований у
центрі куба, тому щільність пакування
буде становити
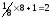 .
.
Порожнини між атомами
Також структура ОЦК має два типи порожнеч. Відносно великі порожнечі займають грані кубу елементарної комірки (рис. 1.2, г). Ці порожнечі оточені чотирма атомами, що розташовані у вершинах правильного тетраедра. Більш дрібні порожнечі, оточені шістьма атомами, що займають місця у вершинах неправильного октаедра, розташовуються посередині ребер і граней куба елементарного осередку (рис. 1.2, в). Октаедричні порожнини мають розмір, який становить 0,41r, а тетраедричні – 0,225r. (де r – атомний радіус)
r =248 пм, r - атомний радіус калію (К).
0,41*248 =101,68пм - для октаедричних порожнин рубідію.
0,225*248 = 55,8пм - для тетраедричних порожнин рубідію.
Коефіцієнт заповнення складає 68 %.
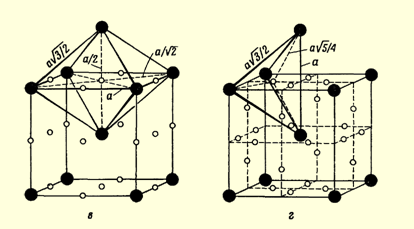
Рис 1.2 : в - октаедричні порожнечі; г - тетраедричні порожнечі
Площини і напрями найщільнішого пакування
У кубічної об’ємноцентрованої ґратки немає щільноупакованих площин, подібних площині (111) у решітках ГЦК. У даному випадку найбільш щільноупакованими є дванадцять площин (110) (рис.1.2,б). У цих площинах є два напрямки, уздовж яких атоми будуть стикатися.

Рис 1.2, б - напрямки найщільнішого упакування в площинах (110);
Список використаної літератури:
-
Энциклопедия неорганических материалов: в 2-х т./ Под редакцией И.М. Федорченко. – К. Изд. УРЭ, 1997.
-
О.М. Бялік, В.С. Черненко, В.М. Писаренко, Ю.Н. Москаленко Металознавство, 2-ге вид-ня. Київ “Політехніка”, 2002. – 382 с.
-
Смитлз К. Дж. Металлы: Справочник/Пер. с англ. - М. Металлургия, 1980. - 447с.
-
Венецкий С.И. В мире металлов, изд. 2-е. – М.: Металлургия, 1988. -168с.
