- •2.1 Дебай-Хюккель теориясы
- •2.2 Дэвис және Гюггенгейм теориялары
- •2.3 Гюнтельберг теориясы
- •III Есептелу бөлімі
- •1. Иондық атмосфераның қалыңдығы :
- •3. Дэвис және Гюггенгейм теңдеулері арқылы орташа-иондық активтілікті есептеу:
- •4. Гюнтельберг теңдеуі арқылы орташа-иондық активтілікті есептеу:
- •Қорытынды
- •V Пайдалынылған әдебиеттер:
|
МАЗМҰНЫ
|
| |
|
I |
Кіріспе |
3 |
|
II |
Негізгі бөлім |
5 |
|
2.1 |
Дебай-Хюккель теориясы |
5 |
|
2.2 |
Дэвис және Гюггенгейм теориялары |
7 |
|
2.3 |
Гюнтельберг теориясы |
7 |
|
III |
Есептелу бөлімі |
8 |
|
IV |
Қорытынды |
17 |
|
V |
Пайдаланылған әдебиеттер
|
18 |
Кіріспе
Жұмыстың мақсаты: CoCl2 электролиті үшін иондық атмосфераның қалыңдығын және орташа активтілік коэффициентін Дебай-Хюккель,Дэвис-Гюггенгейм,Гюнтельберг формулалары арқылы есептеу.
Алынған
иондық атмосфераның қалыңдығы,орташа
активтілік коэффициентімен иондық күш
арасында
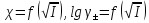 тәуелділік
графигін тұрғызу арқылы қалай өзгеретінін
анықтап, қорытындылау.
тәуелділік
графигін тұрғызу арқылы қалай өзгеретінін
анықтап, қорытындылау.
Көрінетін дәрежеде электр тоғын өткізетін ерітінділерді электролит ерітінділері деп атайды, ал суда немесе басқа еріткіштерде еріткенде электр өткізгіш ерітінділерін түзетін заттар электролиттер болып табылады. Мысалы, ас тұзы, сірке қышқылы, хлорлы барий және т.б., олардың сулы ерітінділерінің электрөткізгіштігі жеткілікті жоғары. Электролит ерітінділерінің электрөткізгіштігі, оларды суда немесе басқа еріткіштерде еріткенде электролит молекулалары иондарға – электр заряды бар бөлшектерге ыдырағандықтан пайда болады. Электр өріс әсерінен иондардың жылжу қабілеті бар, сол электролит ерітінділерінің электрөткізгіштігін анықтайды.
Сұйылтылған электролит ерітінділерінің ерекшеліктері Аррениустың электролитикалық диссоциалану теориясы арқылы ұғындырылған.
Аррениустың электролитикалық диссоциалану теориясы. 1883 – 1887жж Аррениус дамытқан электролитикалық диссоциалану теориясы келесі жайдыңдарға(положения) негізделеді.
1. Электролит деп аталатын бірқатар заттардың молекулалары ерітіндіде оң (+) және теріс (–) зарядталған иондарға ыдырайды. Электролиттердің еріген кезінде ыдырауын электролитикалық диссоциалану процесі деп аталды.
2. Еріген кезде молекуланың тек қана қандай да бір бөлігі иондарға ыдырайды. Иондарға ыдырайтын молекулалар үлесі нақты бір температурада заттың табиғатына және оның концентрациясына тәуелді.
Электролитикалық диссоциация классикалық теориясының кемшіліктері
Аррениус теориясы ұсынып отырған электролиттердің сандық сипаттамасының бірі, осы ерітіндідегі иондалған молекулалар үлесін анықтайтын электролитикалық диссоциациялану дәрежесі a. Оның физикалық мағынасына сәйкес a 1 -ден жоғары немесе 0 -ден төмен бола алмайды; берілген жағдайда оны өлшеу әдісіне (электрөткізгіштігін, осмостық қысымын немесе ЭҚК өлшеу) тәуелсіз өзгеріссіз қала беру керек. Бірақ іс жүзінде әртүрлі әдістермен алынған a мәні тек қана әлсіз электролиттердің сұйылтылған ерітінділері үшін сәйкес болып келеді; күшті электролиттер үшін электролит концентрациясы жөғары болған сайын айырмашылығы да көп болады, және концентарцияның жоғары мәндерінде a 1 -ден жоғары болады.
Сондықтан, Аррениус теориясы беретін a да сол физикалық мағына болмайды.
Аррениус теориясы ұсынып отырған электролиттердің сандық сипаттамасының екіншісі диссоциалану константасы болып табылады; ол берілген Т мен Р да осы электролит үшін ерітінді концентрациясына тәуелсіз тұрақты болу керек. Іс жүзінде тек сұйылтылған өте әлсіз электролиттер үшін Кд,с сұйылтқанда тұрақты бола береді.
Электролит ерітінділердегі тепе-теңдікті термодинамикалық сипаттау.
Ион-дипольді әрекеттесу электролит ерітінділердің түзілуі мен тұрақтылығын физикалық түрде түсіндіріп бере алады. Бірақ бұл ерітінділердің сандық сипаттамасын алу үшін ион-ионды әрекеттесуді ескеру қажет.
Сулы ерітінділерде иондар бір-бірінен үлкен арақашықтықта орналасқан кезде көбінесе электростатикалық әрекеттесу болады. Ерітінді концентрациясы жоғарлаған сайын иондар бір-біріне жақындай бастағанда жеке ионның сольваттық қабықшалары жабылып, иондардың электростатикалық әрекеттесуі ион-дипольді әрекеттесумен күрделінеді. Кейбір кезде аниондар мен катиондар жақындаған кезде ассоциация жүреді де, ол кездегі иондар арасындағы әрекеттесу күшін электростатикалық деп санауға болмайды. Одан да қатты электростатикалық емес әрекеттесу электролит ерітіндіде комплексті ион және диссоцияланбаған молекула түзілгенде пайда болады.
Алайда әртүрлі иондардың қасиеттері бірдей емес, сондықтан әр иондардың түріне жеке термодинамикалық функция енгізіп, қарастыруға болады:
+ = +о + RT ln a+ = +o + RT ln m+ + RT ln + ,
–= –о + RT ln a– = –o + RT ln m– + RT ln – ,
мұнда + және – активтіліктің практикалық коэффициенті (концентрациясы, моляльность m -ға тең кездегі активтілік коэффициенті).
Әртүрлі иондардың термодинамикалық қасиетін тек тәжірибелік мәндермен анықтай алмаймыз. Қосымша жұмыстар жасау керек; біз тек осы заттың молекуласы бөлінетін ионның орташа термодинамикалық мәнін ғана олшей аламыз.
II Негізгі бөлім
2.1 Дебай-Хюккель теориясы
Электролит ерітінділер теориясының негізгі жайыттары 1923ж Дебай және Хюккельмен айтылған. Электролиттердің статистикалық теориясы келесі жағдайларға сәйкес келеді: иондар ерітінді көлемінде ретсіз таралмай, кулонның әсерлесу заңына сәйкес таралған. Жеке иондардың жан-жағында ион атмосферасы (ион бұлты) бар – ол тқарама – қарсы зарядталған ионнан тұратын сфера. Сфера құрамына кіретін иондар үздіксіз басқа иондармен орнын ауыстырып отырады. Ерітіндідегі барлық иондар бірдей (тең), олардың әрбіреуі иондық атмосферасымен қоршалған, сонымен қатар центрлік ион басқа ионның иондық атмосферасының құрамына кіреді.
χ
=
 -
ерітінді концентрациясына
-
ерітінді концентрациясына
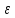 және Т -ға тәуелді шама, бірақ потенциалға
тәуелді емес; ұзындыққа кері өлшем
бірлігіне ие; бұл орталық ионның
жан-жағындағы иондық атмосфераның
орталық ионнан
r
арақашықтыққа алыстаған кездегі
тығыздығының өзгерісін сипаттайды.
және Т -ға тәуелді шама, бірақ потенциалға
тәуелді емес; ұзындыққа кері өлшем
бірлігіне ие; бұл орталық ионның
жан-жағындағы иондық атмосфераның
орталық ионнан
r
арақашықтыққа алыстаған кездегі
тығыздығының өзгерісін сипаттайды.
1/c шама сипаттамалық ұзындық деп атайды; оны иондық атмосфераның радиусымен теңдестіруге болады. Ол электролит ерітіндісінің теориясында үлкен мәнге ие.
Активтілік коэффициенті үшін келесі теңдеу алынған:
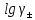 =
-
A |z+×z-|
=
-
A |z+×z-|
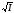 (1)
(1)
А коэффициенті Т және D -ға тәуелді, (DT)3/2 -ге кері пропорционал
1-1 зарядты электролиттердің сулы ерітіндісі үшін 298К –де, ерітіндінің диэлектрлік өткізгіштігі және еріткіш (78,54) тең деп алып, келесідей жазуға болады:
 =
-
A
=
-
A
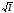 =-
A
=-
A
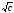 =-
0,51
=-
0,51

Сөйтіп, электролиттің сұйылтылған ерітінділері үшін эмпириялық табылған теңдеуі сияқты Дебай және Хюккель теориясы да активтілік коэффициенті үшін теңдеу алуға мүмкіндік береді. Яғни, теория тәжірибемен сапалық сәйкестікте жатыр. Осы теорияны өңдеген кезде келесі жорамалдар жасалды:
Электролиттегі иондар санын электролиттің аналитикалық концентарциясынан табуға болады, өйткені ол электролит толық диссоциаланған (a = 1) деп есептеді. Сондықтан, Дебай және Хюккель теориясын кейбір кездерде толық диссоциация теориясы деп те айтады. Бірақ оны a ¹ 1 кездерде де қолдануға болады.
Есептеу жүргізілгенде ерітінді мен таза еріткіштің дтэлектрлік өткізгіштігі тең деп алынады, бұл тек сұйылтылған ерітінділер үшін ғана жарамды (н/е дұрыс).
Айтылып кеткен жорамалдарға байланысты Дебай және Хюккель теориясы тек төмен валенттілікке ие иондары бар сұйылтылған электролит ерітінділерге қолданылады. (1) теңдеу осы шекті жағдайға сәйкес келеді және Дебай-Хюккельдің шекті заңы деп аталады немесе Дебай-Хюккельдің бірінші жақындау теориясын көрсетеді.
Дебай-Хюккельдің шекті заңы 1-1 зарядты электролиттің, әсіресе өте сұйылтылған ерітінділер үшін, активтілік коэффициенттердің дұрыс мәндерін береді. Теорияның тәжірибемен сәйкестігі электролит концентрациясы, ион заряды өскен сайын және еріткіштің диэлектрлік өткізгіштігі төмендеген сайын, яғни иондардың арасындағы әрекеттесу күші өсуімен, төмендейді.
Екінші жақындауда орташа активтілік коэффициенті келесі теңдеумен сипатталады:
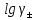 =
-
=
-
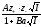 (2)
(2)
мұнда
А бұрынғы мәнін сақтайды;
а
ионның
орташа эффективті диаметрі
деп аталған, ұзындық өлшеміне ие,
эмпириалық тұрақты; В = c/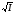 ,
В Т -мен бірге біраз өзгереді. Сулы
ерітінділер үшін Ва
1 -ге жуық.
,
В Т -мен бірге біраз өзгереді. Сулы
ерітінділер үшін Ва
1 -ге жуық.
Теорияның екінші жақындауындағы негізгі жағдайларды сақтап Хюккель ерітінді концентрациясы өскен кезде диэлектрлік өткізгіштік тқмендейтінін ескерді. Оның төмендеуі еріткіштің дипольінің ионның жан-жағында бағытталуына байланысты, осының нәтижесінде сыртқы өрістің эффектісіне олардың рекциясы төмендейді. Хюккель теңдеуі келсі түрде беріледі:
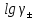 =
-
=
-
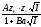 + CI
(3)
+ CI
(3)
мұнда С –эмпириялық константа.
В және С мәндерін дұрыс таңдаған кезде Хюккель формуласы тәжірибемен жақсы сәйкес келеді және есептеу кезінде кең қолданылады. Иондық күш төмендеген кезде (3) теңдеу Дебай және Хюккельдің екінші жақындау теориясының формуласына айналды ((2) теңдеу), содан кейін Дебай-Хюккельдің шекті заңына ((1) теңдеу).
Дебай-Хюккель теориясы ары қарай дамыған кезде және қабылданған жорамалдарды ескермеген кезде оның тәжірибемен сәйкестігі жақсарады және оның қолданылу аймағы кеңейеді, алайда бұған теориялық теңдеудің жартылай эмпириялыққа айналған кезде ғана қол жеткізе аламыз.
Дебай және Хюккель ионның заряды мен потенциалының байланысы арқылы, Лаплас опператорын қолдана отырып, иондық атмосфераның қалыңдығын тапты:
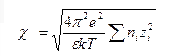
Бұл теңдеуді былай өзгертейік: