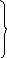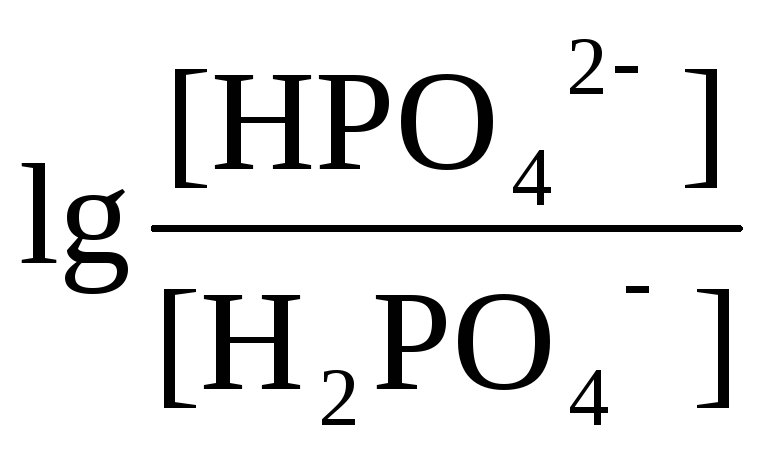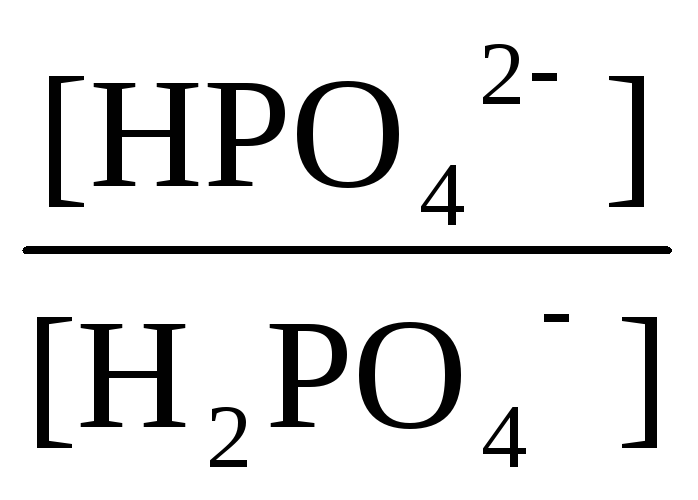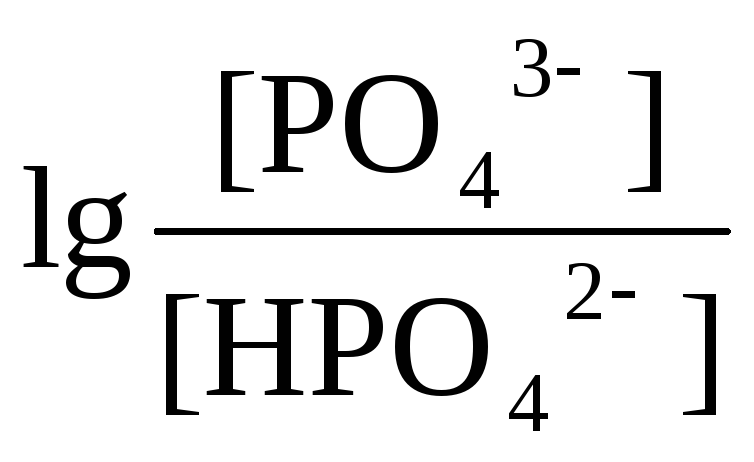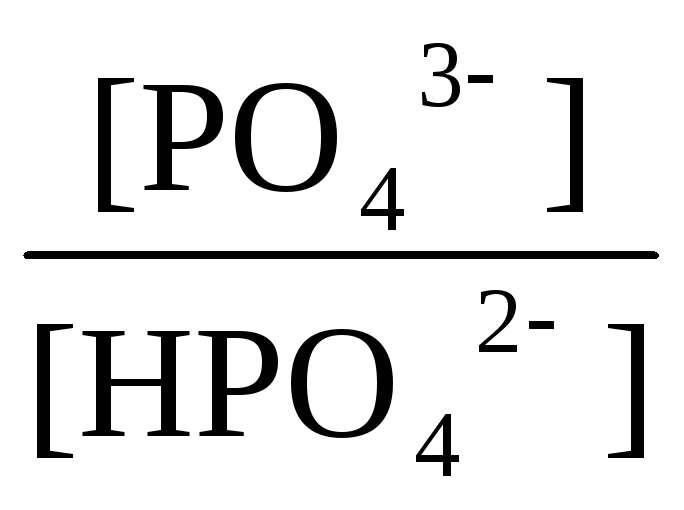АХТТ.Маг.Дрістер №1-30.2015 г. (1)
.doc«Аналитикалық химияның таңдаулы тараулары» пәні бойынша оқылатын дәрістердің мазмұны.
1-2 - Дәрістер. Күшті және әлсіз қышқылдардың (негіздердің) өте сұйытылған ерітінділерінің қышқылдығын анықтайтын факторлар мен процесстер.
Концентрациясы 10-6 М төмен күшті қышқылдар мен негіздердің өте сұйытылған ерітінділері үшін рН есептегенде су диссоциациясын ескеру қажет.
Бірнегізді күшті қышқыл үшін электрбейтараптық теңдеуді құрамыз:
[H+] = [OH-] + [An-] (26)
Күшті қышқыл және еріткіш – су диссоциациясы процестеріне сүйене отырып:
НА ® Н+ + А-; Н2О Û Н+ + ОН-
[A-]=CHA, күшті қышқыл болғандықтан толық диссоциацияланады. (26) теңдеуден:
[OH-] = [H+] - [An-] = [H+] - CHCl (27)
(27) теңдеуді судың иондық туындысының теңдеуіне қоямыз:
КН2О = [H+][OH-] = [H+]([H+] - CHCl)
Теңдеудің барлық мүшесін сол жаққа ауыстырамыз:
[H+]2 - [H+].CHCl - KH2O = 0
![]() (28)
(28)
10-8 М HCl ерітіндінің рН-ын (28) теңдеумен есептейміз:
![]()
pH = -lg 1,05.10-7 = 6,98 pH = 6,98 .
Тұз қышқылының өте сұйылтылған ерітіндісі қышқылдығын есептегенде еріткіш үлесін ескермесе мүмкін емес жауап рН = 8,0 болар еді.
Диссоциация дәрежесі төмен әлсіз қышқылдар (негіздер)
Әлсіз қышқылдар жарым-жартылай диссоциацияланады:
НА Û Н+ + А-
Қышқылдың ионизация процесі диссоциация константасымен сипатталады:
![]()
СНА³103 К болғанда, қышқыл диссоциациясының аз дәрежесінде [HA]дбаған»СНА деп болжауға болады.
[H+]
= [A-]
болғандықтан КНА
=
![]() .
Бұдан
.
Бұдан
![]() ;
рН = 1/2(рКНА
+ рСНА)
(29)
;
рН = 1/2(рКНА
+ рСНА)
(29)
рН есептеу үшін бұл теңдеуді диссоциация дәрежесі 5%-дан төмен қышқылдарға қолданады: СН3СООН, Н3ВО3, Н2S, Н2СО3, бензой, валериан, май, фенилсірке, пропион, синиль және т.б.
Аммоний хлориді ерітіндісінің 0,1 М рН-ын есептейміз:
NH![]() + H2O
Û
H3O+
+ NH3
+ H2O
Û
H3O+
+ NH3
қышқыл негіз
![]()
Аммоний иондары әлсіз қышқыл болғандықтан, мынаны болжауға болады
[NH4+] = CNH4+ = 10-1 г-ион/л
Бұдан: ![]() ; рН =
5,13.
; рН =
5,13.
Сусыз
этил спиртіндегі (![]() )
0,001М құмырсқа
қышқылы ерітіндісінің рН
есептейміз:
)
0,001М құмырсқа
қышқылы ерітіндісінің рН
есептейміз:
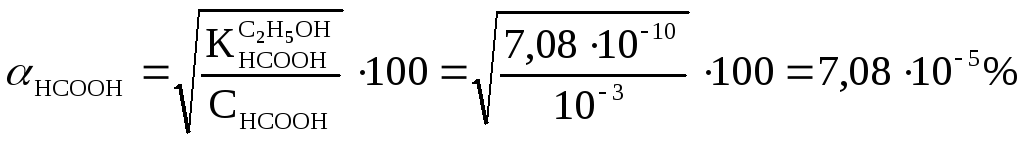
Демек:
![]() ;
рН
= 6,08.
;
рН
= 6,08.
Әлсіз негіз үшін (CB<10-4M, a<5%) ерітінді қышқылдығын есептеу (30) теңдеумен жүргізіледі:
![]() (30)
(30)
Натрий ацетатының 0,1М ерітіндісінің рН-ын есептейміз.
СН3СОО- + Н2О Û СН3СООН + ОН-
негіз қышқыл
![]()
![]() ;
рН =
8,88.
;
рН =
8,88.
Диссоциация дәрежесі төмен әлсіз қышқылдың сұйытылған ерітінділері
Сутек және гидроксил иондарымен қамтамасыз ететін еріткіш - судың диссоциациясын ескере отырып, әлсіз қышқылдың сұйытылған ерітіндісінің (СНА<10-4¸10-5) рН-ын есптеу үшін теңдеу шығарамыз.
НА Û Н+ + А- [H+] = [A-] + [OH-] (33)
H2O Û H+ + OH-
KW
= [H+][OH-]
![]()
![]() (34), [HA]нд»СНА
және
[H+]¹[A-]
болғанда
(34), [HA]нд»СНА
және
[H+]¹[A-]
болғанда
![]() (35)
(35)
(34) және (35) теңдеулерін (33) теңдеуге қоямыз:
![]() ;
[HA+]2
= KHA
.
CHA
+ KW
;
;
[HA+]2
= KHA
.
CHA
+ KW
;
![]() (36)
(36)
Қаралып отырған категорияға жататын негіз үшін:
![]()
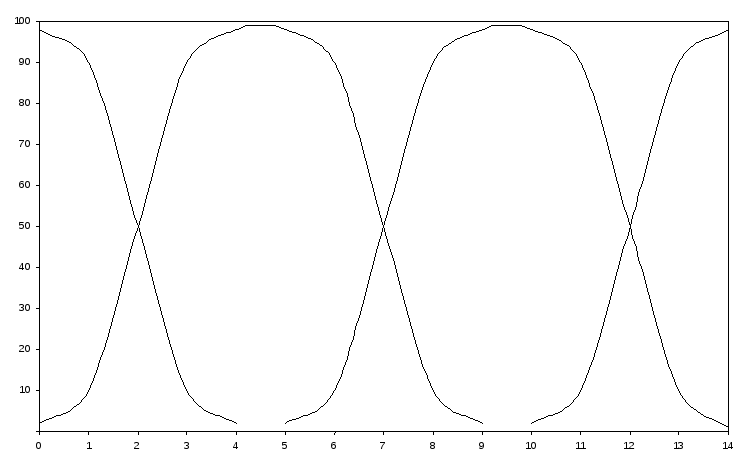
4-суретте көрсетілген қисықтардың талдауы мынаны көрсетеді: рН=8-ден бастап күшті қышқыл үшін ерітіндіні сұйылтуды ескере отырып рН есептегенде, күшті қышқыл концентрациясына тәуелсіз рН тұрақтылығы байқалады. рН=6 дейін ерітінді қышқылдығы қышқыл концентрациясымен анықталады, рН=6-дан рН=8 дейін ерітінді қышқылдығына қышқыл да, еріткіш те үлесін қосады, ал рН=8 кейін ерітінді қышқылдығы тек еріткіш - сумен анықталады.
Әлсіз қышқыл үшін (<<-аминопропион немесе хлорлылау5%), мысалы, қышқыл үшін (4-сурет) еріткіш рН-тың төмен мәнінде әрекеттесуге түседі және КНА төмен болған сайын ертерек әрекеттеседі. Қатты сұйылтылған қышқылды ескермей қышқыл ерітіндісінің рН-ын жуық шамамен есептегенде, рН-gCHA тәуелділігі әлсіз және күшті қышқылдар үшін А және В нүктелерінде қиылысады. Ол, біз қарастырған қышқылдар үшін, осы нүктеден кейінгі концентрациялар үшін сутек ионының концентрациясын есептеуді қышқылдың жалпы концентрациясы бойынша жүргізуге болатынын көрсетеді, себебі: өте сұйылтылғанда әлсіз қышқылдың диссоциация константасының мәні жоққа жуық.
|
pH -lgCHA A B |
4-сурет. Қышқылдың электролиттік диссоциация константасы және концентрациясының ерітінді қышқылдығына әсері
 -
қышқылды сұйылта отырып есептелген
рН--lgСНА
тәуелділігінің қисығы;
-
қышқылды сұйылта отырып есептелген
рН--lgСНА
тәуелділігінің қисығы;
 -
қышқылдың сұйылтуын ескермей есептелген
рН--lgCНА
тәуелділігінің қисығы;
-
қышқылдың сұйылтуын ескермей есептелген
рН--lgCНА
тәуелділігінің қисығы;
 - a-
аминопропион қышқылы үшін (КНА
= 7.10-10);
- a-
аминопропион қышқылы үшін (КНА
= 7.10-10);
 -хлорлылау
қышқылы үшін (КНА
= 2,95.10-8);
-хлорлылау
қышқылы үшін (КНА
= 2,95.10-8);
 - күшті бір
негізді қышқыл үшін.
- күшті бір
негізді қышқыл үшін.
Сонымен, СНА=10-7 (В нүктесінде) болғанда хлорлылау қышқылы (HСlO) үшін:
![]() 7рН
.
Қышқылдың
мұндай концентрациясында ерітіндінің
рН-ын келесі жолмен есептеуге болады:
[H+]
= CHClO4
= 10-7
рН = 7 .
7рН
.
Қышқылдың
мұндай концентрациясында ерітіндінің
рН-ын келесі жолмен есептеуге болады:
[H+]
= CHClO4
= 10-7
рН = 7 .
3-4 - Дәрістер. Күші орта қышқылдардың өте сұйытылған ерітінділерінің қышқылдығын анықтайтын факторлар мен процесстер. Күші орташа қышқылдар (H3PO4, HF, H2C4H4O6, H3AsO4 және т.б.) ерітінділері рН-ын есептеу. Әлсіз қышқылдардың өте сұйытылған ерітінділері (СHnA ≤ 10-4 M) рН-ын есептеу.
Күші орташа қышқылдар (негіздер) ерітінділері.
Диссоциация дәрежесі 5-тен 30% дейін қышқылдар үшін (H3PO4, HF, H3AsO4, H2C4H4O6 және т.б.) [HA]дбаған шамамен қышқылдың жалпы концентрациясына тең деп болжауға болмайды.
[HA]дбаған
= СНА
– [H+]
, сонда
![]()
[H+]
= [A-]
болғанда
![]() (31)
(31)
(31) теңдеуден: [H+]2 + KHA[H+] – KHA.CHA = 0
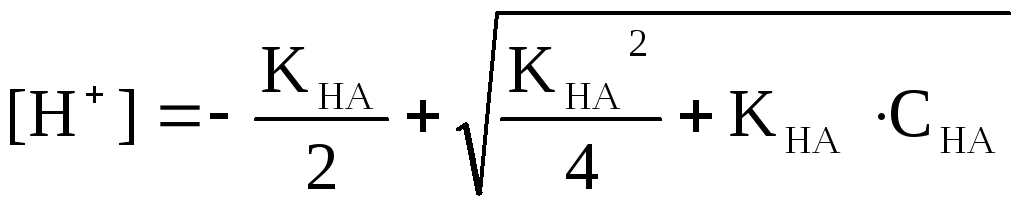 (32)
(32)
Азотты қышқылдың 0,1М ерітіндісінің рН-ын есептейік. 30% шегінде болатын қышқылдарғаАзотты қышқылдың диссоциация дәрежесі 5 жататынына көз жеткіземіз:
![]()
Азотты қышқылдың 0,1М ерітіндісінің қышқылдылығын (32) теңдеу бойынша есептейміз:
![]() рН
= 2,06
рН
= 2,06
Концентрациясы 10-4 М-нен жоғары және диссоциация дәрежесі 5%-дан жоғары негіздер ерітінділерінің рН-ын ұқсас формуламен есептейміз:
 (33)
(33)
СО32- негіз диссоциациясының дәрежесін есептейміз:
![]() ;
;
![]()
СО32- негіздің 0,1 М ерітіндісінің қышқылдығын есептейміз:
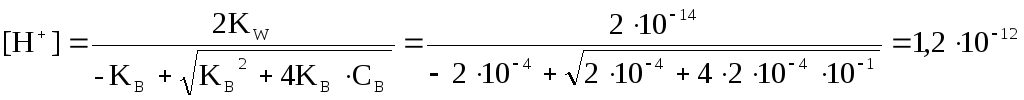
рН = 11,90
5-6 - Дәрістер. Әлсіз қышқылдар аниондарының мольдік мөлшерінің ерітінді рН-на тәуелді-лігінің протолиттік тепе-теңдігін талдау (« α - рН» тәуелділігі диаграммасы).
Аналитикалық химияда қышқылдың, негіздің, амфолиттің және буферлік қоспалардың сулы ерітінділеріндегі рН мәнін бағалау өте маңызды. Толық бөлу және иондарды анық сапалық табу үшін талдаудың жүйелік әдісінде (S2-, CO32-, H2PO4- және т.б.) топтық реактив болып табылатын әлсіз қышқыл аниондарының мөлшерін есептей білу керек.
Сулы ерітіндіде әлсіз қышқылдың түрлі формалары болуының айырмашылықтары арасындағы тепе-теңдікті графикалық көрсету ыңғайлы. Қышқылдың түрлі формаларының мольдік үлесі сулы ерітінді рН-на тәуелділік диаграммалары, үлестіру диаграммалары, артық мөлшерде болу аймақтар диаграммалары бар.
Сулы ерітінді рН-на сірке қышқылы және ацетат иондардың болуының тәуелділігінің диаграммасын, үлестіру диаграмманы және артық мөлшерде болу аймақтар диаграммаларын тұрғызамыз және қарастырамыз:
НА
Н+
+ А-
![]() ;
;
![]()
![]()
Ерітінді рН-на тәуелді сулы ерітіндідегі сірке қышқылының түрлі формаларының болуы бойынша есептік мәндер.
|
рН |
|
|
[CH3COOH], % |
[CH3COO-], % |
|
3 |
2 |
100 |
99,0 |
1,0 |
|
4 |
1 |
10 |
90,0 |
10,0 |
|
5 |
0 |
1 |
50,0 |
50,0 |
|
6 |
-1 |
0,1 |
10,0 |
90,0 |
|
7 |
-2 |
0,01 |
1,0 |
99,0 |
|
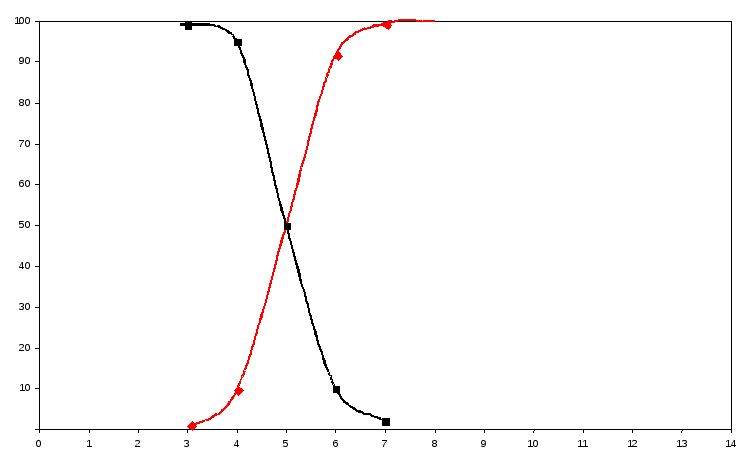
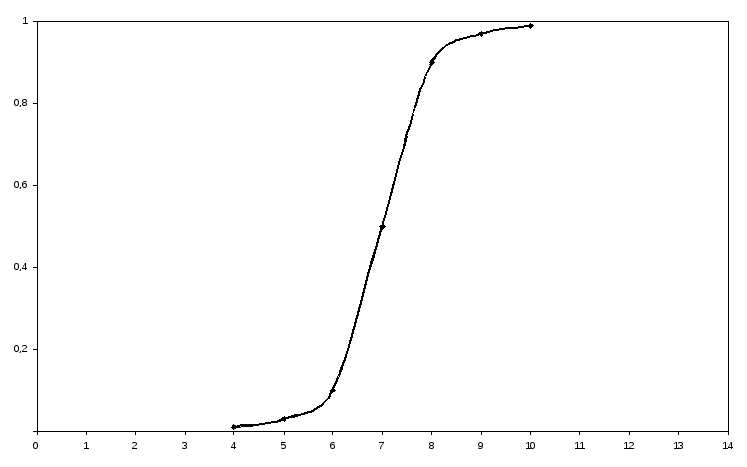
% pH СH3СООН СН3СОО- pH=pK1 |
||||
11-сурет. Сулы ерітінді рН-на сірке қышқылы мен ацетат иондары массалық үлесінің тәуелділігі
Бұл диаграмма бойынша рН5 максималды буферлік сиымдылығында сірке қышқылы ерітіндісінде буферлік қоспа СН3СООН+СН3СОО- бар.
Үлестіру диаграммалар қышқылдың әртүрлі формаларын мольдік үлеспен біртіндеп қосу арқылы алынады.
|
Σх XCH3COOH XCH3COO- pH |
12-сурет. Сірке қышқылы және ацетат-иондардың үлестіру диаграммалары
Артық мөлшерде болу аймақтар диаграммаларынан қышқылдың (негіздің) бір түрі көп мөлшерде болу рН аймағын көруге болады.
|
CH3COOH CH3COO-
|
13-сурет. Сулы ерітіндідегі сірке қышқылы және ацетат-иондардың артық мөлшерде болу аймақтар диаграммасы
Сулы ерітіндідегі екінегізді қышқылдың түрлі формалары тәуелділік диаграммасын, үлестіру диаграмманы, түрлі формалардың артық мөлшерде болу аймақтар диаграммасын тұрғызамыз.
H2S
H+
+ HS-
![]()
![]() ;
;
![]()
HS-
H+
+ S2-
![]()
![]() ;
;
![]()
Сулы ерітіндідегі күкіртсутек қышқылының әртүрлі формалары болуының рН-тан тәуелділік есептік мәні
11кесте
|
рН |
|
|
[HS-], % |
[H2S], % |
pH |
|
|
[S2-], % |
[HS-], % |
|
4 |
-3 |
10-3 |
0,1 |
99,9 |
12 |
-3 |
10-3 |
0,1 |
99,9 |
|
5 |
-2 |
10-2 |
1,0 |
99,0 |
13 |
-2 |
10-2 |
1,0 |
99,0 |
|
6 |
-1 |
10-1 |
10,0 |
90,0 |
14 |
-1 |
10-1 |
10 |
90,0 |
|
7 |
0 |
1 |
50,0 |
50,0 |
|
|
|
|
|
|
8 |
1 |
10 |
90,0 |
10 |
|
|
|
|
|
|
9 |
2 |
100 |
99,0 |
1,0 |
|
|
|
|
|
|
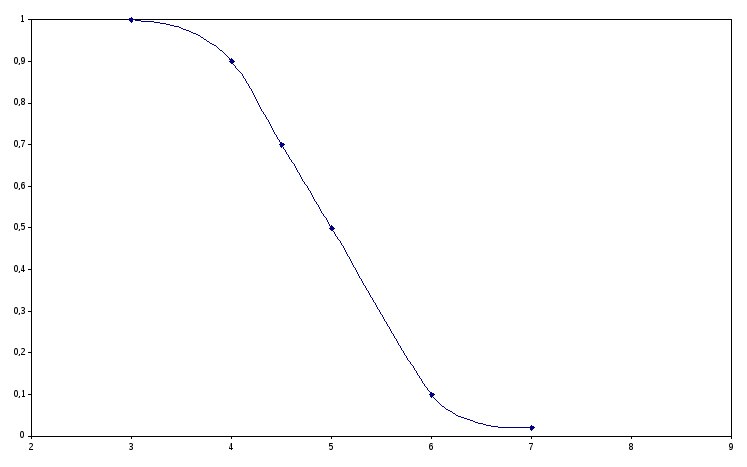
% pH H2S HS- S2- HS- pH=pK1 |
14-сурет. Күкіртсутек молекулалары, гидросульфид-иондары және сульфид-иондары массалық үлесінің сулы ерітінді рН-нан тәуелділігі
рН=0,5 жағдайында талдаудың күкіртсутектік жүйелік әдісінде топтық реактив болып табылатын сульфид-иондарының мольдік үлесін есептейміз:
![]()
Есептеулерден диаграммадан сияқты күшті қышқыл ортада сульфид-иондардың концентрациясы өте төмен және күкіртсутекпен мыс пен күшән топшасының қиын еритін сульфидтерін тұндыруға болатынын көруге болады.
рН = 9 болғанда
![]()

Әлсіз сілті ортада сульфид-иондарының мөлшері 15 ретке жоғары және көрсетілген ортада ІІІ топтың ерігіш сульфидтерін тұндыру мүмкін.
Диаграмма бойынша рН=7 болғанда буферлік сиымдылығы максимал буферлік қоспа S2- + HS- түзіледі, ол есептеу нәтижелеріне сәйкес.
![]() [H2S]
= [HS-]
болғандықтан, [H+]
= K1;
pH = pK1
[H2S]
= [HS-]
болғандықтан, [H+]
= K1;
pH = pK1
Күкіртсутек қышқылдың түрлі формалары үшін үлестіру диаграммасын тұрғызамыз.
|
HS- H2S pH Σx S2- HS- |
15-сурет. Күкіртсутек, гидросульфид иондар және сульфид-иондардың үлестіру диаграммасы
Артық мөлшерде болу аймақтар диаграммасы келесі түрде болады:
|
H2S HS- pH |
16-сурет. Сулы ерітіндідегі гидросульфид-иондардың және күкіртсутектің артық мөлшерде болу аймақтар диаграммасы
Үшнегізді фосфор қышқылы түрлі формаларының ерітінді рН-на тәуелді ерітіндіде болу диаграммасын тұрғызамыз:
Н3РО4
Н+
+Н2РО42-
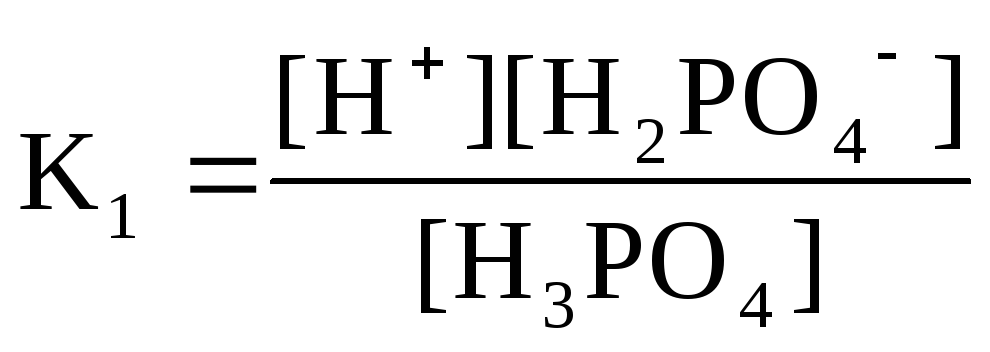
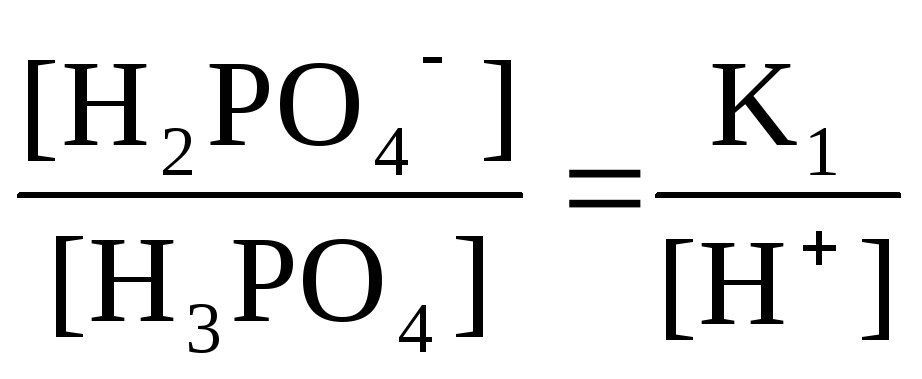 ;
;
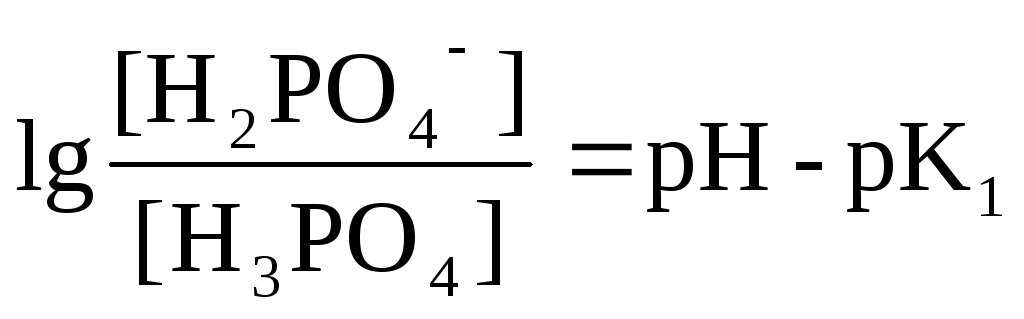
Н2РО4-
Н+
+ НРО42-
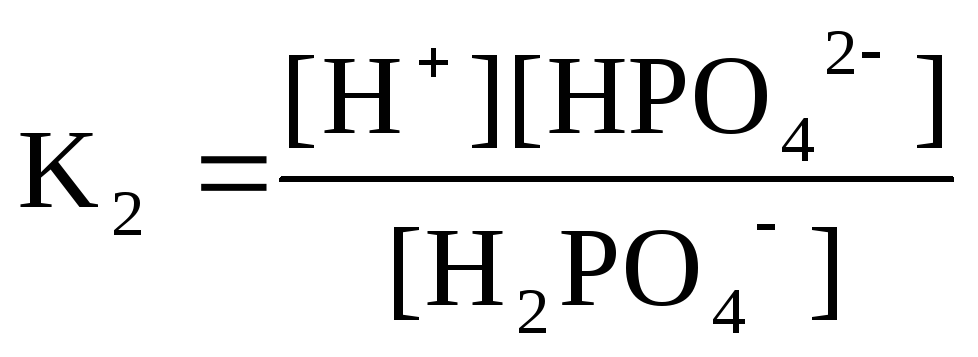 ;
;
 ;
;
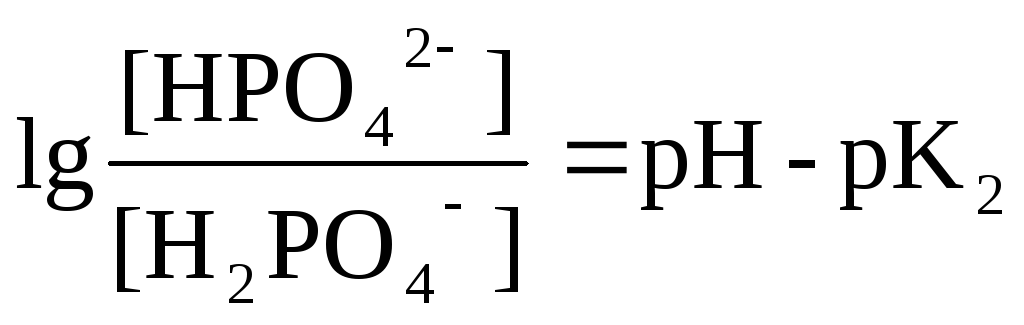
НРО42-
Н+
+ РО43-
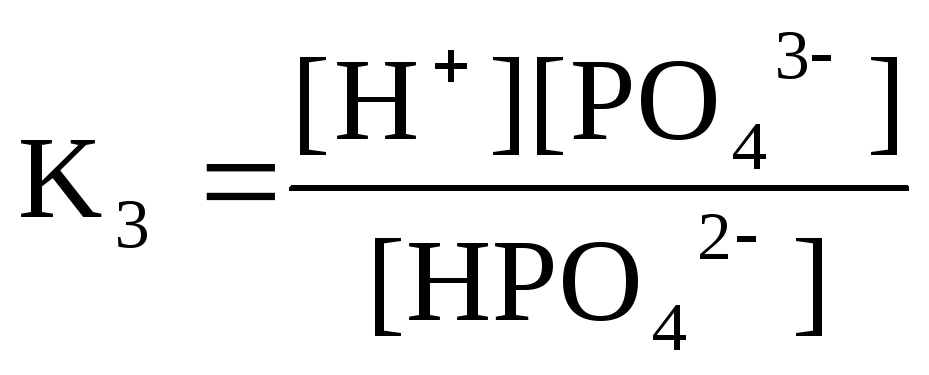 ;
;
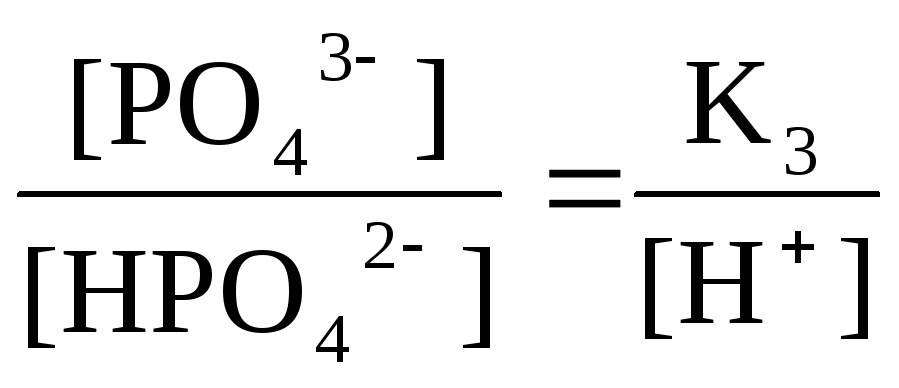 ;
;
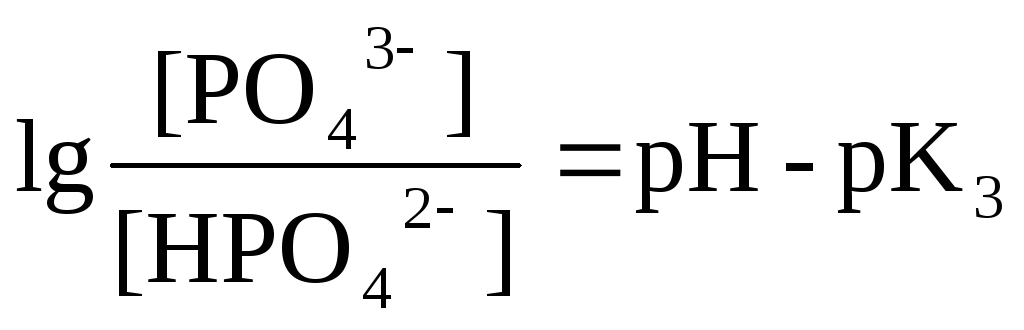
рК1 = 2 рК2 = 7 рК3 = 12
рН-тан тәуелді фосфор қышқылы әртүрлі формалары болуының есептік мәндері
|
рН |
|
|
[H2PO4], % |
[H3PO4], % |
|
0 |
-2 |
10-2 |
1,0 |
99,0 |
|
1 |
-1 |
10‑1 |
10,0 |
90,0 |
|
2 |
0 |
1 |
50,0 |
50,0 |
|
3 |
1 |
10 |
90,0 |
10,0 |
|
4 |
2 |
100 |
99,0 |
1,0 |
|
pH |
|
|
[HPO42-], % |
[H2PO4-], % |
|
5 |
-2 |
10-2 |
1,0 |
99,0 |
|
6 |
-1 |
10-1 |
10,0 |
90,0 |
|
7 |
0 |
1 |
50,0 |
50,0 |
|
8 |
1 |
10 |
90,0 |
10,0 |
|
9 |
2 |
100 |
99,0 |
1,0 |
|
pH |
|
|
[PO43-] |
[HPO42-] |
|
11 |
-2 |
10-2 |
1,0 |
99,0 |
|
12 |
-1 |
10-1 |
10,0 |
90,0 |
|
13 |
0 |
1 |
50,0 |
50,0 |
|
14 |
1 |
10 |
90,0 |
10,0 |
|
pH % [H3PO4] [H2PO4-] [HPO42-] [PO43-] [H2PO4-] [H2PO4-] [HPO42-] [H2PO4-] pH1=pK1 pH2=pK2 pH3=pK3
|