
- •Приклади виконання вправ Приклад 1
- •Приклад 2
- •Приклад 3
- •Приклад 4
- •Приклад 5
- •Приклад 6
- •Приклад 7
- •Приклад 8
- •Приклад 9
- •Приклад 10
- •Приклад 15
- •Вправи для самостійного виконання
- •2. Комплексоутворення в біологічних системах.
- •Приклади виконання вправ Приклад 1
- •Вправи для самостійного виконання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •5. Основи титриметричного аналізу
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади виконання вправ
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Додаток. Деякі математичні відомості
- •Таблиця 9. Таблиця десяткових логарифмів
5. Основи титриметричного аналізу
В основі титриметричного визначення лежить вимірювання об’єму розчину точно відомої молярної концентрації еквівалента речовини, витраченого на реакцію з речовиною, що аналізують, з подальшим розрахунком кількості визначуваної речовини за рівнянням реакції. Розчин реагенту, молярна концентрація якого встановлена з високою точністю, називають робочим, або стандартним, або титрованим розчином (розчином титранту). Розчин, в якому визначають молярну концентрацію еквівалента речовини, називають пробою (аналітом).
|
Обчислення в титриметричному аналізі ґрунтуються на законі еквівалентів: | |||
|
|
В хімічних реакціях кількість молей еквівалентів кожної з речовин, що вступили в реакцію та утворились в ній, завжди рівні між собою. | ||
|
Для довільної реакції між аналітом (А) та титрантом (Т) закон еквівалентів має наступні математичні вираження: | |||
|
1) |
Кількість молей еквівалентів аналіту і титранту, що вступили в реакцію рівні:
| ||
|
2) |
Щоб отримати формулу для розрахунку молярної концентрації еквівалента аналіту за результатами титрування, потрібно виразити кількості молей еквівалентів через молярні концентрації еквівалента та об’єми розчинів, що були введені в реакцію:
| ||
|
3) |
Щоб отримати формулу для розрахунку маси аналіту, яка міститься в розчині, за результатами титрування потрібно у формулі
де | ||
|
|
|
- загальний об’єм розчину, з якого відбиралась проба та вміст аналіту в якому потрібно визначити; | |
|
|
|
- об’єм розчину, який відібрали із загального об’єму для титрування. | |
|
|
Якщо
потрібно визначити масу аналіту, що
міститься в тому об’ємі розчину, який
взяли для титрування, тобто
| ||
Приклади розв’язання задач
|
Приклад 1 | |
|
Визначити молярну концентрацію еквівалентa сульфатної кислоти в розчині, якщо на титрування 10мл цього розчину пішло 12,4мл розчину калій гідроксиду з молярною концентрацією еквівалента 0,01моль/л. | |
|
Дано:
|
Знайти:
|
|
Розв’язок: | |
|
Визначення концентрації сульфатної кислоти проводять за реакцією:
| |
|
Молярну концентрацію еквівалента сульфатної кислоти розрахувати за рівнянням:
| |
|
Відповідь:
| |
|
Приклад 2 | ||
|
Визначити
точну молярну концентрацію еквівалента
розчину хлоридної кислоти, якщо для
його стандартизації використовувався
розчин, для приготування 500мл якого
взято наважку 0,8741г натрій тетраборату
декагідрату
| ||
|
Дано:
|
Знайти:
| |
|
Розв’язок: В основі стандартизації лежить наступна реакція:
| ||
|
1) |
Визначити
молярну концентрацію еквівалента
| |
|
2) |
Визначити
точну молярну концентрацію еквівалента
| |
|
Відповідь:
| ||
|
Приклад 3 | |||
|
На титрування 10мл розчину барій гідроксиду витрачено 10,6мл розчину хлоридної кислоти з молярною концентрацією еквівалента
а) масу барій гідроксиду в 10мл розчину; б) масу барій гідроксиду в 250мл розчину.
| |||
|
Дано:
|
Знайти: а)
б)
| ||
|
Розв’язок: Визначення вмісту барій гідроксиду проводять за реакцією:
| |||
|
а) |
Обчислити масу барій гідроксиду, що міститься в 10мл розчину, за результатами титрування:
| ||
|
б) |
Обчислити масу барій гідроксиду, що міститься в 250мл розчину, за результатами титрування 10мл цього розчину:
| ||
|
Відповідь: |
а)
б)
| ||
|
Приклад 4 | |||
|
Визначити
масу амоніаку, що міститься в 150мл
нашатирного спирту, якщо на титрування
1мл цього розчину витрачено 11,1мл
розчину сульфатної кислоти з молярною
концентрацією еквівалента
| |||
|
Дано:
|
Знайти:
| ||
|
Розв’язок: Визначення вмісту амоніаку проводять за реакцією:
| |||
|
Знайти масу амоніаку, що міститься в 150мл розчину, за результатами титрування 1мл цього розчину:
| |||
|
Відповідь:
| |||
|
Приклад 5 | |||
|
Визначити
масову частку оцтової кислоти в
розчині, якщо на титрування 5мл цього
розчину витрачено 12,9
мл
розчину натрій гідроксиду з молярною
концентрацією еквівалента
| |||
|
Дано:
|
Знайти:
| ||
|
Розв’язок: Визначення вмісту оцтової кислоти проводять за реакцією:
| |||
|
1) |
Визначити молярну концентрацію оцтової кислоти за результатами титрування:
| ||
|
2) |
Розрахувати масову частку оцтової кислоти в розчині, використовуючи формулу, наведену в таблиці 5:
| ||
|
Відповідь:
| |||








 ,
розрахункова формула набуває вигляду:
,
розрахункова формула набуває вигляду:





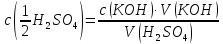


 (бура). На титрування 10мл приготованого
розчину
(бура). На титрування 10мл приготованого
розчину витрачено 8,5мл розчину
витрачено 8,5мл розчину .
.







 в приготованому стандартному розчині:
в приготованому стандартному розчині:



 в
розчині за результатами титрування:
в
розчині за результатами титрування:


 .
Визначити:
.
Визначити:
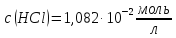













 .
.











 .
Густина
розчину оцтової кислоти
.
Густина
розчину оцтової кислоти
 .
.




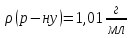
 )-?
)-?




