
- •Приклади виконання вправ Приклад 1
- •Приклад 2
- •Приклад 3
- •Приклад 4
- •Приклад 5
- •Приклад 6
- •Приклад 7
- •Приклад 8
- •Приклад 9
- •Приклад 10
- •Приклад 15
- •Вправи для самостійного виконання
- •2. Комплексоутворення в біологічних системах.
- •Приклади виконання вправ Приклад 1
- •Вправи для самостійного виконання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •5. Основи титриметричного аналізу
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади виконання вправ
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Додаток. Деякі математичні відомості
- •Таблиця 9. Таблиця десяткових логарифмів
Задачі для самостійного розв’язання
|
4.1
Розрахувати молярну концентрацію
вільних іонів H+
та
OH-
при температурі
а)
в розчині трихлороцтової кислоти ( б)
в розчині ціанідної кислоти ( в)
в розчині барій гідроксиду ( г)
в розчині амоніаку
| |
|
Відповідь:
|
а)
б)
в)
г)
|
|
4.2
Обчислити показники
а)
з молярною концентрацією вільних
іонів H+
б)
з молярною концентрацією вільних
іонів OH-
| |
|
Відповідь: |
а)
б)
|
|
4.3
Обчислити показник
| |
|
Відповідь:
|
а)
б)
|
|
4.4
Розрахувати значення
| |
|
Відповідь:
| |
|
4.5
Обчислити показник
| |
|
Відповідь:
| |
|
4.6
Розрахувати молярну концентрацію
вільних іонів H+
и
OH-
в секреті підшлункової залози з
| |
|
Відповідь: |
|
|
4.7
Обчислити масу хлоридної кислоти,
яка
міститься в 300мл розчину з
|
|
Відповідь:
|
|
|
|
4.8
Обчислити масову частку сульфатної
кислоти в розчині з
Густина
розчину 1 |
|
Відповідь:
|
|
4.9
Розрахувати масу барій гідроксиду,
необхідну для приготування 250мл розчину
з
|
|
Відповідь:
|
|
4.10
Розрахувати масову частку амоніаку
( |
|
Відповідь:
|
|
4.11
Водневий показник розчину барій
гідроксиду дорівнює 12. Обчислити
масову концентрацію
|
|
Відповідь:
|
|
4.12 Написати рівняння реакції першої стадії гідролізу та обчислити константу гідролізу для наступних солей: а)
б) в)
| |
|
Відповідь: |
а)
б)
|

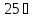 :
: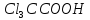 )
з молярною концентрацією
)
з молярною концентрацією
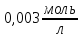 ,
якщо ступінь дисоціації електроліту
89%;
,
якщо ступінь дисоціації електроліту
89%;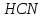 )
з молярною концентрацією
)
з молярною концентрацією
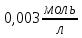 ,
якщо ступінь дисоціації електроліту
0,5%;
,
якщо ступінь дисоціації електроліту
0,5%;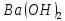 )
з
молярною концентрацією
)
з
молярною концентрацією
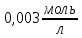 ,
якщо ступінь дисоціації електроліту
100%;
,
якщо ступінь дисоціації електроліту
100%;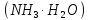 з молярною концентрацією
з молярною концентрацією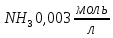 ,
якщо ступінь дисоціації електроліту
7,5%.
,
якщо ступінь дисоціації електроліту
7,5%.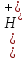 ;
;
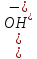 ;
;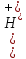 ;
;
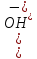 ;
;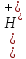 ;
;
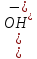 ;
;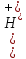 ;
;
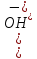 .
.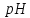 та
та
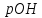 для розчинів:
для розчинів: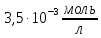 ;
; .
.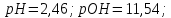
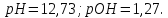
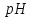 для
розчинів а) нітратної кислоти (
для
розчинів а) нітратної кислоти (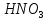 )
з
молярною концентрацією
)
з
молярною концентрацією
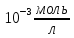 ;
б) барій гідроксиду (
;
б) барій гідроксиду (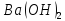 )
з
молярною концентрацією
)
з
молярною концентрацією
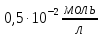 ,
якщо
ступінь дисоціації електролітів 100%.
Як зміниться
,
якщо
ступінь дисоціації електролітів 100%.
Як зміниться
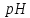 цих
розчинів при розведенні в 100 разів?
цих
розчинів при розведенні в 100 разів?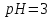 ,
збільшиться на 2;
,
збільшиться на 2;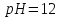 ,
зменшиться на 2
,
зменшиться на 2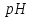 6%-го розчину оцтової кислоти, враховуючи
, що ступінь дисоціації кислоти 0,5% та
густина розчину1
6%-го розчину оцтової кислоти, враховуючи
, що ступінь дисоціації кислоти 0,5% та
густина розчину1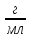 .
.
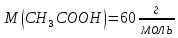
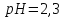
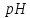 розчину з масовою часткою барій
гідроксиду 0,02% враховуючи, що ступінь
дисоціації електроліту 100% та густина
розчину1
розчину з масовою часткою барій
гідроксиду 0,02% враховуючи, що ступінь
дисоціації електроліту 100% та густина
розчину1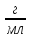 .
.
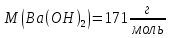
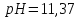
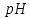 7,7.
7,7.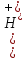 ;
;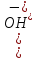
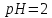 ,
враховуючи,
що
ступінь
дисоціації електроліту 100%.
,
враховуючи,
що
ступінь
дисоціації електроліту 100%. 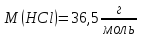
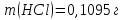
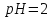 ,
якщо
ступінь дисоціації електроліту 100%.
,
якщо
ступінь дисоціації електроліту 100%. 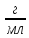 ;
;
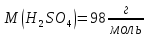
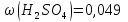
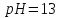 ,
враховуючи, що ступінь дисоціації
електроліту 100%.
,
враховуючи, що ступінь дисоціації
електроліту 100%.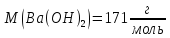 .
.
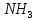 )
в водному розчині,
якщо значення
)
в водному розчині,
якщо значення
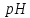 цього
розчину
11,8.
Ступінь дисоціації
цього
розчину
11,8.
Ступінь дисоціації
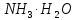 23%;
густина розчину 0,998
23%;
густина розчину 0,998 ;
;
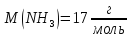
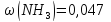
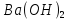 в розчині, враховуючи, що ступінь
дисоціації електроліту 100%.
в розчині, враховуючи, що ступінь
дисоціації електроліту 100%.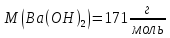 .
.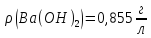
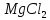 ,
якщо
,
якщо
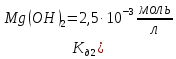 ;
;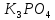 ,
якщо
,
якщо
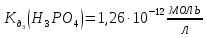 ;
;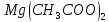 якщо
якщо
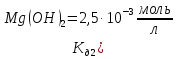 ,
,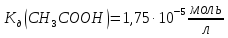 .
.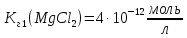 ;
;
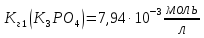 ;
;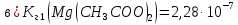 .
.