
- •Приклади виконання вправ Приклад 1
- •Приклад 2
- •Приклад 3
- •Приклад 4
- •Приклад 5
- •Приклад 6
- •Приклад 7
- •Приклад 8
- •Приклад 9
- •Приклад 10
- •Приклад 15
- •Вправи для самостійного виконання
- •2. Комплексоутворення в біологічних системах.
- •Приклади виконання вправ Приклад 1
- •Вправи для самостійного виконання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання.
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •5. Основи титриметричного аналізу
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Приклади виконання вправ
- •Приклади розв’язання задач
- •Задачі для самостійного розв’язання
- •Додаток. Деякі математичні відомості
- •Таблиця 9. Таблиця десяткових логарифмів
Задачі для самостійного розв’язання
|
6.1
Обчислити
| |
|
Відповідь: |
|
|
6.2
Обчислити
| |
|
Відповідь: |
|
|
6.3
Обчислити
| |
|
Відповідь: |
|
|
6.4
Обчислити об’єми розчинів оцтової
кислоти і натрій ацетату з молярними
концентраціями
У відповіді об’єми компонентів буфера виразити в літрах. | |
|
Відповідь: |
|
|
6.5
Обчислити об’єми розчинів натрій
гідрогенфосфату з
У відповіді об’єми компонентів буфера виразити в мілілітрах. | |
|
Відповідь: |
|
|
6.6
Обчислити об’єми розчинів натрій
гідрогенфосфату та натрій
дигидрогенфосфату з концентраціями
У відповіді об’єми компонентів буфера виразити в мілілітрах. | |
|
Відповідь: |
|
|
6.7
Обчислити об’єми розчину амоній
хлориду і розчину амоніаку з молярними
концентраціями
У відповіді об’єми компонентів буфера виразити в літрах. | |
|
Відповідь: |
|
|
6.8
Розрахувати ємність буферного розчину
за кислотою, якщо при титруванні 10,0мл
розчину витрачено 5,3мл розчину хлоридної
кислоти з молярною концентрацією
| |
|
Відповідь: |
|
|
6.9
Розрахувати буферну ємність розчину
за лугом, якщо при титруванні 20,0мл
цього розчину для зміни
| |
|
Відповідь: |
|
|
7. Колігативні властивості розчинів
| |||
|
Таблиця 8. |
Основні параметри, що використовуються для характеристики колігативних властивостей розчинів | ||
|
Параметр |
Позначення, розрахункова формула |
Змістове значення | |
|
Осмотичний тиск |
(i вводиться в формулу для розчинів електролітів) |
Зовнішній тиск на розчин, при якому встановлюється осмотична рівновага (крізь напівпроникну мембрану) між розчином і чистим розчинником.
| |
|
Ізотонічний коефіцієнт |
де
|
Відношення загального числа частинок (молекул та іонів) розчиненої речовини в розчині до вихідного числа молекул речовини, враховує міжмолекулярні взаємодії в реальних розчинах. | |
|
Підвищення
температури кипіння ( |
(i вводиться в формулу для розчинів електролітів) |
Прямо пропорційне моляль-ності речовини в розчині | |
|
Ебуліоскопічна та кріоскопічна константи |
|
Чисельно рівні підвищенню температури кипіння або, відповідно, зниженню температури замерзання одномоляльного ідеального розчину нелеткої речовини порівняно з чистим розчинником. Їх значення залежить лише від природи розчинника і не залежить від природи розчиненої речовини. | |

 амонійного буферного розчину,
приготованого з 600мл розчину амоній
хлориду з
амонійного буферного розчину,
приготованого з 600мл розчину амоній
хлориду з і
800мл розчину амоніаку з
і
800мл розчину амоніаку з
 .
.
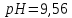
 фосфатного буферного розчину, що
складається з 150мл розчину натрій
дигідрогенфосфату з
фосфатного буферного розчину, що
складається з 150мл розчину натрій
дигідрогенфосфату з та
250мл розчину натрій гідрогенфосфату
з
та
250мл розчину натрій гідрогенфосфату
з
 .
.

 ацетатного буферного розчину,
приготованого з 250мл розчину натрій
ацетату з
ацетатного буферного розчину,
приготованого з 250мл розчину натрій
ацетату з і
300мл розчину оцтової кислоти з
і
300мл розчину оцтової кислоти з
 .
.


 і
і
 ,
а також води, які необхідно змішати,
щоб отримати 1,4л ацетатного буферного
розчину з молярною концентрацією
,
а також води, які необхідно змішати,
щоб отримати 1,4л ацетатного буферного
розчину з молярною концентрацією та
та
 .
.



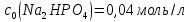 та натрій дигідрогенфосфату з
та натрій дигідрогенфосфату з
 ,
а
також води, які необхідно змішати,
щоб отримати 750мл фосфатного буферного
розчину з молярною концентрацією
,
а
також води, які необхідно змішати,
щоб отримати 750мл фосфатного буферного
розчину з молярною концентрацією
 та
та .
.
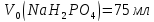

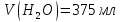
 і
і
 ,
необхідні
для приготування 600мл фосфатного
буферного розчину з
,
необхідні
для приготування 600мл фосфатного
буферного розчину з
 .
.


 і
і
 ,
які
потрібно змішати, щоб приготувати
1500мл амонійного буферного розчину з
,
які
потрібно змішати, щоб приготувати
1500мл амонійного буферного розчину з
 .
.


 на зменшення
на зменшення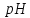 від 4,1 до 3,3?
від 4,1 до 3,3?
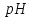 від 7,1 до 8,3 витрачено 7,4мл розчину
калій гідроксиду з молярною концентрацією
0,02 моль/л?
від 7,1 до 8,3 витрачено 7,4мл розчину
калій гідроксиду з молярною концентрацією
0,02 моль/л?


 ;
;
 -
ступінь дисоціації;
-
ступінь дисоціації; -кількість
іонів, на які розпадається даний
електроліт
-кількість
іонів, на які розпадається даний
електроліт )
або зниження температури замерзання
(
)
або зниження температури замерзання
( )
ідеальних, або нескінченно розведених,
розчинів нелетких речовин
)
ідеальних, або нескінченно розведених,
розчинів нелетких речовин


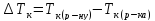


 ,
,
