
- •1.Загальна теорія поглинання світла молекулами.
- •2.Апаратура для вимірювання поглинання у видимому та ультрафіолетовому світлі.
- •2.1Спектрофотометри
- •3. Методика спектрофотометричних вимірювань
- •4.Фактори, що впливають на абсорбціонні властивості хромофора.
- •5.4Приклад 4. Асоціація білка .
- •6.Поглинання поляризованого світла.
- •7. Інфрачервона спектроскопія
- •7.1 Методика вимірювань
- •7.2Інформація, що міститься в інфрачервоних спектрах
7.2Інформація, що міститься в інфрачервоних спектрах
По-перше, необхідно відмітити що при зображені ІЧ-спектрів використовується хвильові числа 1/ λ або частоти v ,а не довжини хвилі. У термінах частот кожна, лінія в ІЧ-спектрі може бути охарактеризована частотою максимума поглинання (v-макс) ,шириною лінії на половині висоти v1/2 оптичної щільності ліній , отриманих коли електричний вектор світлової хвилі паралельний і перпендикулярний осі молекули . В результаті численних досліджень мономерів відомої структури тепер точно встановлено ,якій групі і якому типу коливання відповідає кожна полоса в спектрі. В випадку простих простих з’єднань ІЧ-спектрів відрізняються від спектрів в видимому і ультрафіолетовому світлі тим ,що вони складаються із вузьких ліній .(рис.7-2).Проте в випадку макромолекул настільки велике число типів зв’язків і так багато різних конформацій ,що кожна лінія зміщується в тій або іншій степені в залежності від положення відповідної групи в молекулі ,так що всі лінії перекриваються і внаслідок цього в спектрі знаходиться декілька відносно широких ліній .
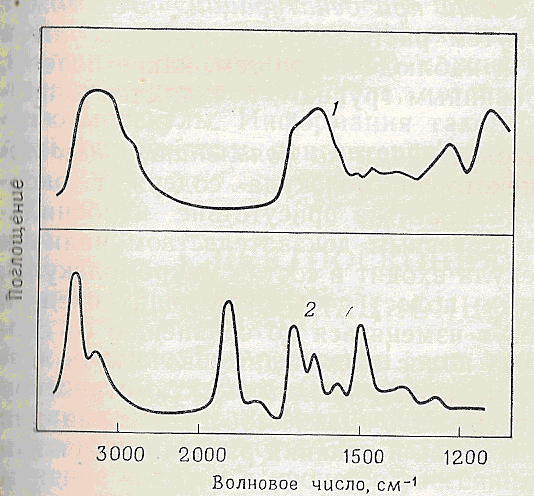
рис.7-2.
ІЧ- спектри ДНК (1) і стеаринової кислоти (2).
8.Виявлення фальсифікації органічних лікарських речовин ,випробування на чистоту спектрофотометрією в ультрафіолетовому спектрі. Інфрачервоні спектри поглинання та їх застосування для ідентифікації лікарських речовин.
Спектрофотометрія в ультрафіолетовій області є одним з основних загальних методів аналізу лікарських речовин та їх препаратів, включених в будь-яку сучасну фармакопею.
Встановлення залежності між будовою речовин і їх електронними спектрами є складною проблемою, розгляд якої знаходиться поза межами даної роботи. Слід, однак, зупинитися на деяких закономірностях, що визначають характер спектрів.
Поглинання в ультрафіолетовій і видимій частинах спектра зазвичай пов'язують з наявністю в молекулі речовини певних груп - хромофорів. До них відносяться подвійні і потрійні вуглецеві зв'язки, карбонильна, карбоксильна, азо-, нітро-та інші групи. Відомо також, що деякі групи, не будучи хромофорною, збільшують інтенсивність забарвлення речовини - такі групи називають ауксохромними, або ауксохромами. Типовими прикладами ауксохромів можуть бути гідроксильна та аміногрупи.
Вплив різних замісників на характер поглинання зручно спостерігати при розгляді спектрів простих молекул. Інтерпретація спектрів органічних речовин, що мають складну будову, утруднена через присутність в молекулі більш ніж однієї хромофорної і ауксохромної групи. Часто певні групи хромофорів проявляються спектрально як єдиний комплекс. Так, наприклад, структура бензолу має характерні смуги поглинання при 200 і при 255 нм.
Якщо введення нової групи в молекулу речовини не зачіпає наявні хромофорної структури, то не станеться якоїсь значної зміни спектра. Тому ряд фармакопейних речовин (фенамін, ефедрин і лідол) мають типову смугу поглинання бензолу при 257 нм.
При введенні в бензольне ядро фенольної групи смуга поглинання зміщується до області 280 нм, де особливо зростає вплив розчинника, тому що є можливість утворення ауксохрома у вигляді - ВІН (кисла і нейтральне середовище) або О-(лужне середовище). Типовими прикладами одноатомних фенолів є морфін і естрадіол, і двоатомних фенолів - адреналін і ізопреналін.
Інтенсивне поглинання багатьох кетостероїдів повністю залежить від пов'язаною системи Золото А. Інші групи в молекулі не роблять впливу на характер спектра. Тому ряд стероїдів (преднізон, преднізолон, прогестерон, дезоксикортикостерону, гідрокортизон, кортизон і метилтестостерон) має подібний спектр з максимумом близько 240 ім.
Похідні барбітурової кислоти проявляють максимум при рН 7 внаслідок виникнення хромофорної групи:
Для ідентифікації невідомої речовини в органічній аналітичній хімії спектр досліджуваної речовини зазвичай порівнюють з отриманим при тих же умовах спектром речовини, будова якого відома.
Встановлення автентичності речовини по ультрафіолетового спектру є цінним доповненням до хімічних і фізико-хімічних методів фармакопейного аналізу. Далі ми розглядаємо деякі випадки поглинання в ультрафіолетовій області, використовувані поруч фармакопей для визначення автентичності органічних лікарських речовин.
Вказівка довжин хвиль при максимумах поглинання є лише орієнтовною характеристикою, так як не дає можливості судити про вид спектра.
0,002% розчин препарату в 0,01 Н розчині соляної кислоти в області від 220 до 350 нм має максимум поглинання близько 251 нм (Имизин, ГФХ).
В даному випадку, очевидно, слід або цілком проміряти зазначену область, що за відсутності реєструючого приладу вимагає значного часу, або зробити ряд вимірювань в області, близької до 251 нм, наприклад ± 10 нм, і встановити максимум.
Найчастіше призводять максимуми і мінімуми при певних довжинах хвиль і відповідні величини поглинання.
Ультрафіолетовий спектр розчину в 0,1 Н соляній кислоті має два максимуми - при 241 нм і при 291 нм, поглинання 0,001% розчину при товщині шару 1 см при 241 нм, близько 0,50 і при 291 нм, близько 0,67. (Антазоліна гідрохлорид, Міжнародна фармакопея, Друге видання).
Іноді величину поглинання виражають у вигляді питомої показника поглинання, Е (1%, 1 см).
Питомий показник поглинання, Е (1%, 1 см), при довжині хвилі 278 нм 290-305 (0,002% водний розчин) (Левоміцетин, ГФХ).
Якщо крива поглинання змінюється в залежності від pH розчину, вказують значення pH, при якому проводиться вимірювання.
Ультрафіолетовий спектр розчину в фосфатному буфері, pH 7,5, має максимум тільки при 252 нм, поглинання 0,0005 розчину при товщині шару 1 см близько 0,4 (Сульфафуразол, Міжнародна фармакопея, Друге видання).
Розчин в 0,01 н. їдкому натре має максимум при 326 нм, Е (1%, 1 см) - близько 65, і мінімум при 294 нм, Е (1%, 1 см) - близько 35.
Розчин в суміші 10 обсягів 0,1 Н соляної кислоти і 40 об'ємів 95% спирту, доведених водою до 100 мл, має максимум при 300 нм, Е (1%, 1 см) - близько 50, і мінімум при 275 нм, Е (1 %, 1 см) - близько 40 (Левотироксин-натрій, Скандинавська фармакопея).
Деякі фармакопеї замість абсолютних величин поглинання приймають ставлення адсорбції при максимумі до абсорбції при мінімумі, що дає можливість до певної міри судити про наявність поглинаючих домішок.
0,001% розчин препарату в 0,1 Н розчині їдкого натра має максимуми поглинання при 256, 283 і 365 нм. Відношення D при 256 нм до D при 365 нм становить 2,8-3,0 (Фолієва кислота, ГФХ).
Для феноксіметілпеннціілліна за тією ж фармакопеї проводять вимірювання наступним чином.
Близько 0,1 г препарату (точна наважка) розчиняють у 4 мл 5% розчину гідрокарбонату натрію, розводять водою до 500 мл і визначають оптичну щільність (D) при довжині хвилі 268 нм і при довжині хвилі 274 нм в кюветі з товщиною шару 1 см . Контрольним розчином служать 4 мл 5% розчину гідрокарбонату натрію , розведені водою до 500 мл.
Відношення D при довжині хвилі 268 нм до D при довжині хвилі 274 їм повинно бути не менше 1,21 і не більше 1,24.
У разі стандарту ідентифікація речовин зводиться до порівняння двох спектрів поглинання, отриманих при одних і тих же умовах.
Ультрафіолетовий спектр 0,0005% розчину у спирті має максимуми і мінімуми яри тих же довжинах хвиль, що н розчин стандарту, однакової концентрації і одночасно виміряний; відповідні величини поглинання, розраховані на суху речовину, при максимумі поглинання близько 281 нм не відрізняються більш ніж на 3% (Егінілестрадіол, Фармакопея США XVII).
Останній метод забезпечує найбільш достовірні результати і має бути рекомендований для фармакопейних випробувань на справжність.
Випробування на чистоту спектрофотометрією в ультрафіолетовому спектрі.
Метод спектрофотометрії в ультрафіолетовій області успішно використовується як для ідентифікації та кількісного визначення, так і у випробуваннях на чистоту.
Застосування ультрафіолетової спектрофотометрії для перевірки доброякісності фармакопейних препаратів є найбільш цінним у випадках, коли домішки або продукти розкладання поглинають в області, відмінній від досліджуваного речовини. Таким чином визначають зміст адреналона, що має максимум при 310 нм, в адреналіні, максимум поглинання при 278 нм.
Вказуються у фармакопейних статтях величини поглинання, що визначають граничний вміст домішки , встановлюються емпіричним шляхом.
3-оксіфенілтріметіламмоній бромід, супутній неостігміну броміду, має максимум при 294 нм.
Поглинання 0,05% розчину в 0,1 М карбонат натрію при 294 нм не більш 0,03 - межа вмісту 3 мг на 1 г (Неостнгмнн бромід, Скандинавська фармакопея).
Аналогічно визначається зміст гітоксін в дигітоксин з Міжнародної фармакопеї Другого видання.
Розчиняють близько 5 мг препарату (точна наважка) в 1 мл метилового спирту і доводять гліцерином або концентрованою соляною кислотою до обсягу 25 мл. Поглинання цього розчину після години стояння при 352 нм близько 0,28 (не більше 5%).
Межа змісту поглинаючих домішок може бути встановлена за величиною відносин абсорбції при різних максимумах. При аналізі ціаіокобаламіна по Державній фармакопеї X видання визначають оптичну щільність (D) розчину, приготованого для кількісного визначення в кюветі з товщиною шару 1 см при довжинах хвиль 278, 361 і 548 нм.
Відношення D при 361 нм до D при 548 нм повинно бути від 3,0 до 3,4.
Відношення D при 361 нм до D при 278 нм повинно бути від 1,7 до 1,88.
Вивчення ультрафіолетових спектрів є цінним при випробуваннях на чистоту і при дослідженнях стабільності лікарських засобів, якщо зміни в характері спектра дозволяють судити про зміни і перетвореннях речовини.
Інфрачервоні спектри поглинання та їх застосування для ідентифікації лікарських речовин.
Оцінення інфрачервоних спектрів поглинання є більш складною, ніж ультрафіолетових, внаслідок великої кількості смуг, що в той же час складає основу ідентифікації речовини (рис. 8).
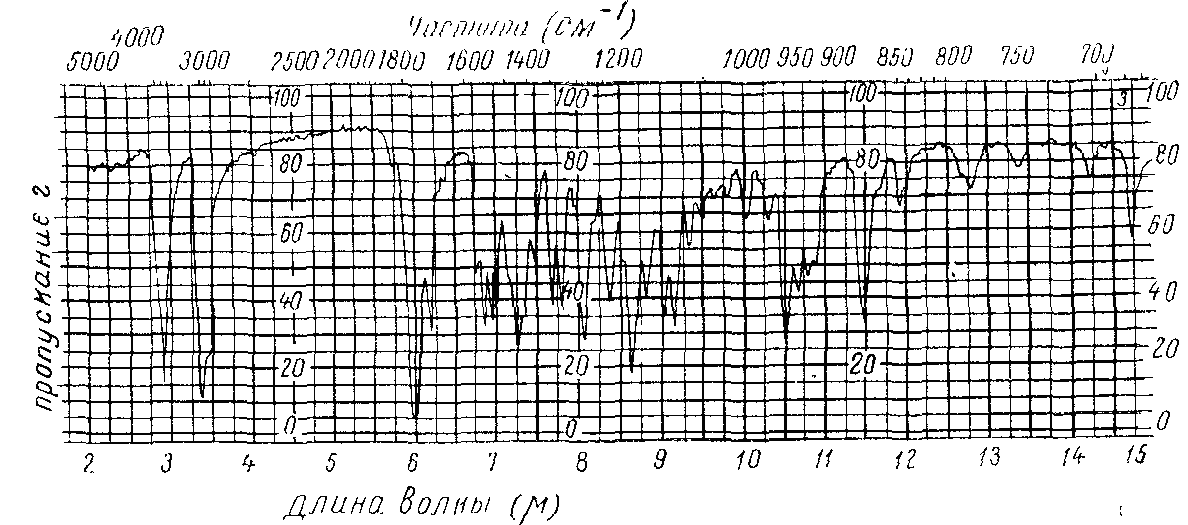
рис.8 ІЧ –спектр метилтестостерона ,дисперсія в броміде.
Для інтерпретації спектрів зазвичай використовують наявні дані про зв'язок між інфрачервоними смугами поглинання і структурними елементами молекул. Такі дані зводяться, як правило, у вигляді кореляційних таблиць-діаграм.
В області від 2,5 до 6,5 мкм за допомогою таблиць по сильному та середньому поглинанню можна з певною точністю ідентифікувати певну функціональну групу. Інфрачервоні смуги поглинання, що відповідають валентним коливанням С-Н, знаходяться в області 3,3 мкм, для аліфатичних сполук характерні смуги лежать від 3,3 до 3,7 мкм; для ароматичних речовин - від 3,2 до 3,3 мкм. Вільна гідроксильна група матиме слабку, але чітко виражену смугу при 2,75 мкм, водневий зв'язок значно збільшить її інтенсивність і викличе зміщення порожнини до 2,85 або до 3,0 мкм.
Наявність смуг валентних коливань = С - Н при 3,3 мкм і коливань в області від 6,1 до 6,25 мкм вказує на присутність речовини, що має структуру ароматичного типу. Положення смуг поглинання певної функціональної групи не є постійним в застосуванні до різних молекул внаслідок впливу сусідніх атомів і груп. Наприклад, положення карбоніла, С = 0, при 5,75-5,8 мкм, характерно для альдегідів і кетонів; при 6,0 - 6,1 мкм - для кислот; при 5,75 - 5,85 мкм - для ефірів ; ангідриди мають дві смуги поглинання: при 4,9 - 5,05 мкм і при 5,60 - 5,75 мкм.
Нижче 6,25 мкм, проте, співвідношення між характерними частотами діаграми і спостережуваними при досвіді частотами не дотримується, тому що в цій області проявляються характеристики не окремих функціональних груп, а всієї молекули. Це явище пояснюється частково тим, що тут існує багато смуг для більшості молекул і що немає простого способу встановлення відповідності смуг поглинання певним коливанням і положення смуг в більшій мірі піддається непередбачуваних змін. Насамперед залежність характеру спектра поглинання від будови певної молекули може бути пов'язана з фактом, що існують багато коливаннь, що мають приблизно однакову частоту, і що ці коливання взаємодіють один з одним.
Область від 8 до 15 мкм носить іноді назва області «відбитків пальців» (finger print), так як саме ця частина спектру обумовлює унікальність спектру окремої речовини.
Існує кілька можливостей опису фармакопейних випробувань на справжність з допомогою інфрачервоних спектрофотометричних вимірювань.
Насамперед це видання збірників інфрачервоних спектрів для речовин, включених до фармакопею, з тим, щоб згодом ці спектри використовувалися для порівняння з відповідним спектром досліджуваної речовини. Колекції інфрачервоних спектрів постійно публікуються і розширюються. Описано спектри стандартних речовин, включених до Фармакопею США XVI.
Інша можливість представляє вказівка довжин хвиль, при яких спостерігаються смуги поглинання, і вираз їх інтенсивності як сильної, середньої, слабкої і змінної.
Інфрачервоні спектри, будучи унікальним засобом ідентифікації речовини, в той же час, як було показано вище, схильні до впливу багатьох чинників. Спектри можуть бути різними в двох різних спектроскопів. Якість розчинників, умови приготування зразка для аналізу, кристалічні форми речовини складають короткий перелік факторів, що впливають на спектр. У зв'язку з цим у фармакопейному аналізі основним правилом для інфрачервоної ідентифікації є отримання спектра стандартної речовини в той же час і за тих же умов, що і спектр зразка, з подальшим порівнянням двох спектрів.
Британська фармакопея 1968 р. і Міжнародна фармакопея Другого видання описують визначення інфрачервоного поглинання для встановлення автентичності стероїдів, глікозидів і напівсинтетичних пеніцилінів. У розділі загальних методів аналізу викладаються методики вимірювань у вигляді суспензії і у вигляді дисперсії з лужним галоїдів.
До Державної фармакопеї X видання вперше включена інфрачервона спектрофотометрія для аналізу натрієвих солей метициліну та оксациліну і фторотан (галотан).
Інфрачервоний спектр препарату має ті ж максимуми поглинання, що і стандартний зразок натрієвої солі метициліну (метициліну натрієва сіль, ГФХ).
Розчиняють 50 мг речовини в 25 мл води або збовтують еквівалентну кількість порошку таблеток або вмісту капсул з 25 мл 0,01 Н соляної кислоти протягом 10 хвилин. Переносять рідину в ділильну воронку, фільтруючи, якщо необхідно, і промиваючи фільтр і залишок невеликими порціями води. У другій ділильної воронки розчиняють 50 мг стандарту в 25 мл води. Потім кожен розчин обробляють таким чином: додають 2 мл 10% розчину їдкого натра і 4 мл сірковуглецю і струшують протягом 2 хвилин. Центрифугують, якщо необхідно зробити прозорою нижню фазу, і фільтрують її через сухий фільтр, збираючи фільтрат в невелику колбу з притертою пробкою. Визначають спектри поглинання обох відфільтрованих розчинів без затримки, в кюветі 1 мм в області від 7 до 15 мкм у відповідному спектрофотометрі, застосовуючи в якості контрольного розчину сірковуглець. Спектр розчину, отриманий з зразка, має всі найважливіші смуги поглинання, що й розчин стандарту. Якщо спектр зразка має смуги, що відрізняються від стандарту, зразок може бути підданий очищенню і досвід повторений.
Для інших речовин в Фармакопеї США XVII описується визначення з дисперсією препарату в броміді калію.
Висновки
Спектрофотометрія - оптичний метод дослідження газоподібних, рідких і твердих речовин, заснований на визначенні інтенсивності поглинання світла речовиною (абсорбційна спектрофотометрія) або інтенсивності випромінювання їм світла (емісійна спектрофотометрія) залежно від довжини хвилі.
Отримані при цьому (за допомогою спеціальних приладів - спектрофотометрів) абсорбційні та емісійні спектри є характерними для кожного даної речовини.
Розрізняють спектрофотометрію в ультрафіолетовій (УФ), видимій та інфрачервоній (ІЧ) областях спектру.
Спектрофотометрія широко застосовується в клінічних, біохімічних, санітарно-гігієнічних, судово-медичних і фармацевтичних лабораторіях для якісного та кількісного аналізу різного роду об'єктів біологічного походження (сироватка крові, спинномозкова рідина, сеча та ін), лікарських засобів, продуктів харчування і т. д .
Спектрофотометрія в ультрафіолетовій області є одним з основних загальних методів аналізу лікарських речовин та їх препаратів, включених в будь-яку сучасну фармакопею.
Для ідентифікації невідомої речовини в органічній аналітичної хімії спектр досліджуваного речовини зазвичай порівнюють з отриманим при тих же умовах спектром речовини, будова якого відомо.
Встановлення автентичності речовини по ультрафіолетового спектру є цінним доповненням до хімічних і фізико-хімічних методів фармакопейного аналізу.
Метод спектрофотометрії в ультрафіолетовій області успішно використовується як для ідентифікації та кількісного визначення, так і у випробуваннях на чистоту.
Список використаної літератури:
1.Сенов П.Л. Руководство к лабораторным занятиям по фармацевтической химии.
2.Фрайфелдер Физическая биохимия .м.: «Мир»
3.Максютина Н.П., Каган Ф.Е., Митченко Ф.А. и др. Методы идентификации
лекарственных препаратов.
4.Крючкова Г.М., Любина А.Я., М.Э. Полеес. Руководство у практическим
занятиям по технике лабораторных работ.
5.Державна Фармакопея України .-1-е вид.-Харків :РІРЕГ,2001.-с.58-68.
6.Булатов М.И. Практическое руководство по фотометрическим методам анализа - 5-е изд. / Булатов М.И. ,Калинкин И.П. – Л.: Химия ,1986. -432 с.
