
- •1.Загальна теорія поглинання світла молекулами.
- •2.Апаратура для вимірювання поглинання у видимому та ультрафіолетовому світлі.
- •2.1Спектрофотометри
- •3. Методика спектрофотометричних вимірювань
- •4.Фактори, що впливають на абсорбціонні властивості хромофора.
- •5.4Приклад 4. Асоціація білка .
- •6.Поглинання поляризованого світла.
- •7. Інфрачервона спектроскопія
- •7.1 Методика вимірювань
- •7.2Інформація, що міститься в інфрачервоних спектрах
4.Фактори, що впливають на абсорбціонні властивості хромофора.
Спектр поглинання хромофора визначається в першу чергу хімічною структурою молекули. Однак λ макс. і E зазнають помітних змін і під впливом оточення . Мається на увазі вплив рН, полярності розчинника або сусідніх молекул і відносна орієнтація сусідніх хромофорів. Саме ці фактори лежать в основі використання абсорбційної спектроскопії для характеристики макромолекул.
Вплив оточення полягає в наступному:
4.1Ефект рН. рН розчину визначає іонну форму іонізуючих хромофорів. На рис. 4-1 показаний приклад ,зображений вплив рН на спектр тирозину.

Рис.4-1.
Спектр поглинання тирозина при рН 6 і 13.Відмітим що, як λ Макс ,так і Е збільшується при дисоціації ОН-групи фенольного залишку
4.2Ефект полярності. У разі полярних хромофорів часто справедливо (особливо якщо молекула містить О, N або S), що λ макс спостерігається при більш коротких довжинах хвиль у полярних розчинниках , що містять гідроксил (Н2О, спиртах), ніж у
неполярних. Приклад наведено на рис. 4-2.
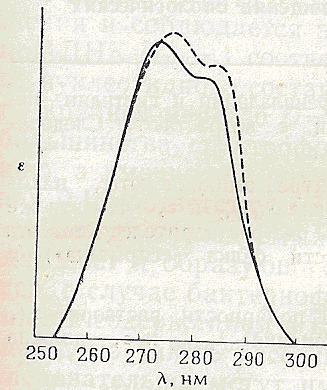
Рис 4-2.
Вплив полярності розчинника на спектр поглинання тирозина .
4.3Ефекти орієнтації. Величини λ макс. і Е істотно залежать від геометричних особливостей молекул. Найбільш відома гіпохромія нуклеїнових кислот, тобто зниження коефіцієнта погашеня нуклеотиду , за умови, що нуклеотид входить до складу одноланцюгового полінуклеотіду , в якому нуклеїнові основи зближені і розташовані один над одним . Подальше пониження Е спостерігається для двох спіральних полінуклеотидів , так як основи в цьому випадку ще більш впорядковані.
Це показано на рис. 4-3.В результаті досліджень великої кількості біологічно важливих з’єднань і макромолекул, структура яких добре
відома для різних умов, зібраний ряд емпіричних фактів, які можуть бути названі робочими правилами абсорбціонної спектроскопії в біохімії. Вони наведені в табл. 1
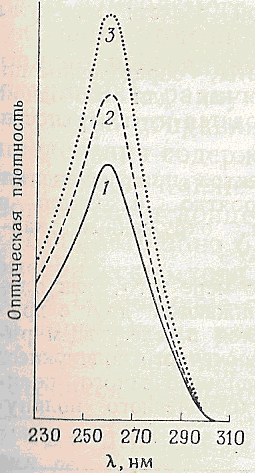
Рис 4-3.
Спектри поглинання ДНК фага Т7 в двоколірній(1) і одноколірній(2) формах ,а також після гідролізу до вільних нуклеотидів (3),що показує пониження оптичної щільності .
ТАБЛИЦЯ 1.
Емпіричні правила інтерпретації спектрів поглинання біологічних
макромолекул
1. Якщо амінокислоти; триптофан, тирозин, фенілаланін і гістидін - переміщуються в менш полярне оточення, λ макс І Е зростають.
а. Якщо в знятому в полярному розчиннику спектрі амінокислоти, знаходяться у складі білка, спостерігаються великі λ макс і Е, чим ті ж величини для вільної амінокислоти в тому ж розчиннику, то ця амінокислота знаходиться у внутрішній області білка («схована ») і оточена неполярними амінокислотами.
б. Якщо спектр білка чутливий до зміни полярності розчинника, амінокислота, для якої спостерігаються зміни λ макс і Е, повинна розташовуватися на поверхні білка.
2. У разі амінокислот λ макс і Е завжди зростають, коли титруєма
група (наприклад, ОН тирозину і SH цистеїну) заряджена. Отже:
а. Якщо не спостерігається змін в спектрі однієї з цих амінокислот,
а рН таке, що мала б відбуватися іонізація вільної амінокислоти, то вона повинна бути захована в неполярній області молекули білка.
б. Якщо значення рК іонізуючої групи амінокислоти, визначене за зміни спектра при зміні рН, таке ж, як для вільної амінокислоти в розчині, то ця амінокислота знаходиться на поверхні білка.
в. Якщо значення рК, визначене за зміни спектра при зміні рН, істотно інше, то ця амінокислота, ймовірно, знаходиться в дуже полярному оточенні (наприклад, тирозин, оточений карбоксильними групами).
3. Величина Е пуринів і піримідинів знижується у міру того, як плоскості їх кілець стають паралельними і кільця зближуються один з другим . Величина Е знижується в наступному ряді : вільна основа > основа в складі одноланцюгового полінуклеотида, що не має сгекінга > основу в складі одноланцюгового полінуклеотиду зі стекінгом > основа у складі двохланцюгового полінуклеотида.
5.Застосування абсорбційної спектроскопії у видимій і УФ-областях спектра.
Вимірювання поглинання проводиться для багатьох цілей: визначення концентрації речовини, аналізу деяких хімічних реакцій, ідентифікації речовин та визначення структурних параметрів макромолекул. Всі ці галузі застосування розглядаються в наступних прикладах.
5.1Приклад 1. Вимірювання концентрації.
Найбільш часто через вимірювання поглинання проводять для визначення концентрації .Це можна робити, якщо відомий молярний коефіцієнт погашення і дотримується закон Бера. Наприклад, для двохланцюгового ДНК D260 = 1 відповідає 50 мкг / мл (ця величина залежить від нуклеотидного складу) . Оскільки закон Бера дотримується
принаймні до D = 2 (яка наближається до межі для більшості спектрофотометрів), легко підрахувати концентрацію, а саме: D, рівна 0,5, відповідає 25 мкг / мл, D, рав-_
ная 0,1, відповідає 5 мкг / мл і т. д.
Іноді досліджуваний матеріал складається з частинок, поглинаючого світла і утворюють швидше суспензію, ніж розчин; наприклад : у разі бактеріофагів, поглинання майже цілком визначається вмістом у них ДНК .Бактеріофаги не тільки поглинають , але також й розсіюють світло (релляївське розсіювання) і,
отже, можуть мати штучно завищене поглинання. Однак, вимірюючи поглинання при ряді довжин хвиль, далеких
від λ макс, можна зробити поправку на розсіювання. Так як розсіяння змінюється пропорційно λ -4, можна побудувати залежність вимірюваного поглинання від λ -4 і, екстраполюючи лінійну частину цієї кривої (де все спостережуване поглинання обумовлене розсіюванням) до λ макс, внести поправку в вимірюване поглинання, що дорівнює величині, обумовленої розсіюванням. Приклад такої поправки зображений на рис. 5.
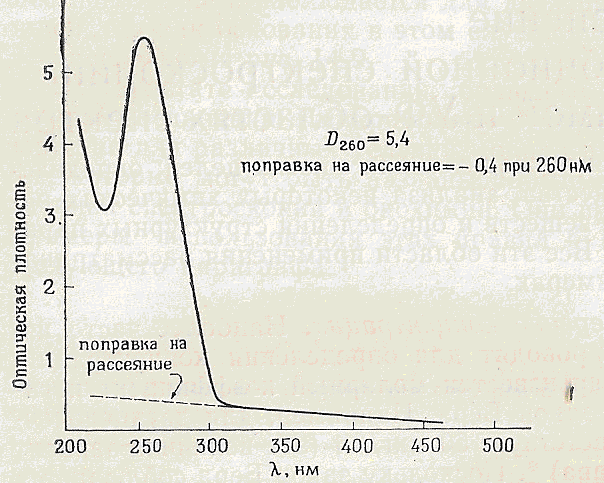
Рис. 5.
Це зручний метод визначення вмісту нуклеїнової кислоти в бактеріофага; враховується також те, що D260 (з поправкою на розсіювання) = 1
відповідає концентрації ДНК 50 мкг / мл.
Концентрацію бактерій також часто визначають спектрофотометричним методом , хоча при використовуваних довжинах хвиль все поглинання обумовлено розсіюванням. У цьому випадку замість поправки на розсіювання проводиться співставлення спостережуваної оптичної щільності з кількістю життєздатних клітин
і будується калібрувальна крива. Таким шляхом, як показано на рис. 5-1, вдається точно визначити концентрацію клітин або сухої маси на одиницю об'єму.
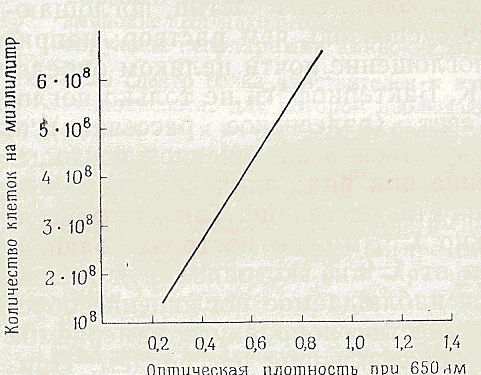
Рис .5-1.Концентрація бактерій , визначена шляхом вимірювання оптичної щільності .
5.2Приклад 2. Дослідження хімічних реакцій.
В ході реакції має змінюватися поглинання одного із реагентів. Розглянемо вимір активності ферменту-галактозидази. Ця методика широко використовується в молекулярній біології при вивченні функціонування лактозного оперону. Цей фермент розщеплює 0-нітрофенілгалактозид (ОНФГ) з утворенням о-нітробензолу, який можна визначити за його поглинання при 420 нм. Так як, в деякому інтервалі, швидкість реакції пропорційна концентрації ферменту, з нахилу кривої залежності D від часу гідролізу (рис. 5-2) можна визначити кількість
ферменту.
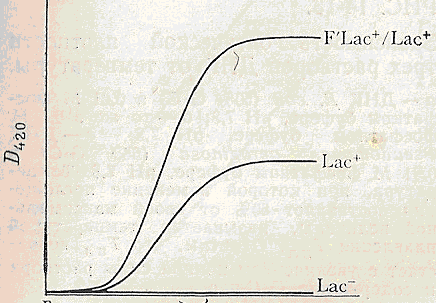
Рис. 5-2 .Час після додавання стимулятора.
Вивчення синтезу -галактозидази шляхом вимірювання D420 продукту гідролізу о-нітрофенілгалактозида (ОНФГ). Три культури : Lac-,Lac+ і диплоїд ,містить дві копії генів lас, вирощувалися в гліцерин-сольовому середовищі.При t = O був доданий стимулятор синтезу -галактозидази. Через відмінні проміжки часу брали проби і обробляли толуолом для того,щоб вбити клітини і відокремити фермент, потім був доданий ОНФГ. Через тридцять хвилин була виміряна D420. У результаті цього досвіду показано, що клітини Lac-не продукують фермент, а диплоїд продукує приблизно в два рази більше, ніж гаплоїди.
5.3Приклад 3. Спектрофотометричне титрування білків.
При багатьох дослідженнях структури білків виникає необхідність визначення величини рК дисоціації протонів іонізуючих бічних груп амінокислот, оскільки ці величини вказують на локалізаuію амінокислоти у білку (правило 2 в табл. 14-2). Це часто можна зробити спектрофотометрично, так як при дисоціації часто змінюється спектр одного з хромофорів (наприклад, у випадку тирозину).Розглянемо гіпотетичний тирозиновмістимий білок і для визначеня числа зовнішніх тирозинових залишків скористаємося правилом 2 (табл. 14-2). Припустимо, що в цьому білку міститься п'ять тирозинових залишків. Якщо всі вони розташовані на
поверхні і іонізуются при збільшенні рН, спектр, відповідаючим залишками тирозину, буде наближатися до спектру вільного тирозину при високих значеннях рН, (правило 2 б). Іншими словами, залежність D295
(λ макс для іонізованої форми) від рН буде виглядати, як
крива А на рис.5-3. Коли ж, навпаки, три тирозинових залишки розташовані всередині в неполярному оточенні, отримана крива аналогічна кривій Б (правило 2а); відношення величини першого плата до кінцевої величини ,що дорівнює 2 / 5. Зазначимо, що при дуже високих рН на кривій видно велике зростання D295. Це вказує на те, що внутрішні тирозинові залишки стали доступні розчиннику, тобто білок денатурувував.
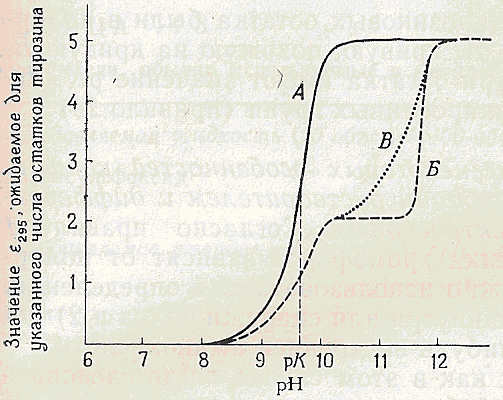
Криві титрування тирозина при будуванні яких використовували Е295.Гипотетичний білок складається з 5 тирозинових залишків.
А-всі 5 залишків находяться на поверхні ; Б-2 залишки на поверхні ,а 3 в середині ,в неполярному оточенні ;В-3 внутрішніх залишки знаходяться в полярному оточенні і доступні розчиннику.Якби три внутрішніх тирозинових залишки були в полярному оточенні, то отримали б криву, схожу на криву В, яка вказує, що ці три залишки мають значення рК (правило 2в).
