
- •Змістовний модуль 4.
- •Питання 2. Метаморфоз та його гормональна регуляція
- •Питання 3. Нейроендокринна регуляція линьки хордових
- •Питання 4. Гормональна регуляція росту.
- •Питання 5. Механізми гуморальної регуляції в організмі
- •Використана література:
- •Питання 2. Шляхи апоптозу клітин
- •Питання 3. Молекулярні механізми апоптозу
- •Питання 4. Шляхи активації апоптозу
- •Питання 5. Апоптосома
- •Регуляція внутрішнього шляху білками родини Bcl-2
- •Питання 6. Апоптоз у рослин
- •Тема 3. Молекулярні основи старіння
- •Питання 1. Загальна характеристика старіння як процесу та його основні характеристики. Біологічний та календарний вік.
- •Календарний та біологічний вік
- •Питання 2.
- •Питання 3.
- •Питання 4. Процеси антистаріння (вітаукта). Тривалість життя та експериментальні способи її продовження
- •Питання для самоперевірки та контролю засвоєння знань
Питання 5. Апоптосома
Цитохром C звільняється з мітохондрій, зв'язуючись з цитозольним білком Apaf-1. Ця взаємодія змінює конформацію Apaf-1, яка стабілізується зв'язуванням ATP, дозволяючи молекулам Apaf-1 асоціювати один з одним в колесоподібний комплекс, що складається з 7 молекул. Apaf-1, цитохром C і ATP - апоптосома, що приєднує 7 молекул прокаспаз-9.
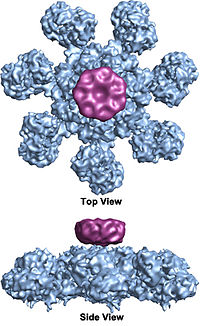
Рис. Апоптосома
Можливі механізми:
1. Apaf-1, цитохром C і прокаспаза-9 – комплекс може активувати цитозольну прокаспазу-9, що входить в апоптосому.
2. Дві апоптосоми взаємодіють одна з одною, активуючи прокаспазу-9. Оксид азоту NO інгібірує апоптоз в лейкоцитах, гепатоцитах, трофобластах і ендотеліальних клітинахх. Ефект може бути викликаний через нітрозилюровання та інактівацію каспаз-3 -1, -8. NO взаємодіє з гемом гуанілат циклази-->синтез сgmp-->актівация cgmp-залежною протеїнкінази-->експресія протиапоптозних білків.
bcl-2 - родина білків регуляторів апоптозу (bc-2, bcl-xl – протиапоптозні) (Bad, Вах – проапоптозні) | чутливість клітин до апоптозних стимул-реакцій може залежати від балансу проти- і проапоптозних bc-2 білків | стрес - проапоптозні bc-2 білки переміщаються на поверхню мітохондрій, інактивуючи антиапоптозні білки, що призводить до утворення пор в мітохондріях і випуску цитохрому з та інших про-апоптозних молекул з міжмембранного простору -->формується апоптосома-->активація каспазового каскаду.
Регуляція внутрішнього шляху білками родини Bcl-2
До родини Bcl-2 належать еволюційно консервативні білки, головною функцією яких є регуляція вивільнення цитохрому c та інших молекул із міжмебранного простору мітохондрій. Серед них є про-апоптичні та анти-апоптичні молекули, які можуть взаємодіяти між собою у різних комбінаціях, пригнічуючи одне одного, баланс між їхньої активністю і визначатиме долю клітини[11].
Проапоптозні складові Bcl-2 збільшують проникність мітохондріальної мембрани, що веде до попадання проапоптозних білків в цитоплазму. Протиапоптозні представники родини - зменшують проникність.
Bcl-2 розділяється на три підродини.
Bcl-2 підродина включає Bcl-2, BCL-XL і Bcl-w - є протиоапоптозними.
Bax підродина включає Bax, Bak и BAD, є проапоптозними білками. Їх послідовності гомологічні регіонам Bcl-2 підродини - BH1, BH2 и BH3, але не регіону BH4.
BH3 підродина з єдиним представником - Bid, у якого гомологічний тільки BH3 регвон. У Bid також відсутній трансмембранний домен.
Існують декулька моделей, як Bcl-2 можуть регулювати проникність мітохондріальноі мембрани.
Представники Bcl-2 родини здатні формувати гомо- и гетеродимери. Гетеродимеризація між про- и проти-апоптозними представниками Bcl-2 інгібує про-апоптозний білок. Bcl-2 білки також здатні утворювати іонні канали (Bcl-xL, Bcl-2 и Bax).
За іншими механізмом Bcl-2 утворюють пори в мітохондріальній мембрані, здійснюючи неспецифічний транспорт невеликих молекул менше 1.5kDa, що порушує синтез ATP і призводить до клітинної смерті. Також цитохром-С і AIF можуть виходити в цитоплазму і утворювати апоптосому. Bax и Bak - індукують вихід цитохрома-С і AIF із мітохондрій.
Зараз відомо близько 20 білків із цієї родини, всі вони містять хоча б один із чотирьох альфа-спіральних доменів гомології Bcl2, що звуться BH1—4 (bcl2 homology). Антиапоптичні білки родини Bcl2 містять всі чотири домени, до них належить сам Bcl-2, а також Bcl-XL, Bcl-w, Mcl-1 та A1. Проапоптичні білки діляться на дві групи, члени першої із яких містять три BH-домени (BH1—3), це зокрема Bak, Bax і Bok (останній експресується тільки у тканинах репродуктивних органів). Найбільш численною серед родини Bcl-2 є друга група проапоптичних білків, які містять тільки домен BH3 (BH3-only), до неї належать Bim, Bid, Bad, Bik/Nbk, Bmf, Nix/BNIP3, Hrk, Noxa, Puma[12].
За нормальних умов (тобто, коли клітина не проходить апоптозу) антиапоптичні білки, такі як Bcl-2 і Bcl-XL, зв'язуються із проапоптичними білками BH123 (Bax і Bak) і не дозволяють їм полімеризуватись у зовнішній мембрані мітохондрій утворюючи пори. Внаслідок дії певного апоптичного стимулу в клітині активуються або починають синтезуватись проапоптичні білки, що містять тільки домен BH3. Вони у свою чергу інгібують антиапоптичні білки, знімаючи їх пригнічувальний ефект на Bak і Bax, або напряму взаємодіють із останніми і сприяють їх олігомеризації та утворенню пор. Внаслідок пермеабілізації зовнішньої мембрани у цитозоль потрапляє цитохром c[11], а також інші медіатори апоптозу, такі як AIF (англ. apoptosis inducing factor).
Наприклад, за браку сигналів виживання у клітині за посередництва MAP-кінази JNK активується експресія BH3 білка Bim, що запускає внутрішній шлях апоптозу. У разі ушкодження ДНК відбувається накопичення супресора пухлин p53, який стимулює транскрипцію генів, що кодують BH3 білки Puma і Noxa, які також забезпечують проходження апоптозу. Ще один BH3 білок — Bid забезпечує зв'язок між зовнішнім та внутрішнім шляхами апоптозу. Після активації рецепторів смерті і, як наслідок, каспази-8, остання розрізає Bid з утворенням усіченої форми tBid (truncated Bid), яка переміщується до мітохонрій, де пригнічує Bcl-2[13].
Список літератури
E. Broker, Frank A.E. Kruyt and Giuseppe Giaccone Cell Death Independent of Caspases: A Review
Edelweiss E, Balandin TG, Ivanova JL, Lutsenko GV, Leonova OG, Popenko VI, Sapozhnikov AM, Deyev SM Barnase as a new therapeutic agent triggering apoptosis in human cancer cells // PLoS One. — Т. 18. — (2008). DOI:10.1371/journal.pone.0002434. PMID 18560598.
↑ а б Alberts et al, 2007, p. 1116
↑ а б в г Alberts et al, 2007, p. 1117
↑ Stepanek O, Brdicka T, Angelisova P, Horvath O, Spicka J, et al. Interaction of Late Apoptotic and Necrotic Cells with Vitronectin // PLoS One. — Т. 4. — (2011). DOI:10.1371/journal.pone.0019243. PMID 21573223.
↑ Alberts et al, 2007, p. 1115
↑ Kroemer G, Galluzzi L, et al Classification of cell death: recommendations of the Nomenclature Committee on Cell ↑ а б Alberts et al, 2007, p. 1116
↑ а б в г Alberts et al, 2007, p. 1117
↑ Stepanek O, Brdicka T, Angelisova P, Horvath O, Spicka J, et al. Interaction of Late Apoptotic and Necrotic Cells with Vitronectin // PLoS One. — Т. 4. — (2011). DOI:10.1371/journal.pone.0019243. PMID 21573223.
↑ Alberts et al, 2007, p. 1115
↑ Kroemer G, Galluzzi L, et al Classification of cell death: recommendations of the Nomenclature Committee on Cell Death 2009 // Cell Death Differ. — Т. 16. — (2009) С. 3-11. PMID 18846107.
↑ а б Alberts et al, 2007, p. 1118
↑ а б в г Alberts et al, 2007, p. 1119
↑ а б в Alberts et al, 2007, p. 1120
↑ а б Alberts et al, 2007, p. 1121
↑ а б Alberts et al, 2007, p. 1122
↑ Szegezdi E, Macdonald DC, Ní Chonghaile T, Gupta S, Samali A Bcl-2 family on guard at the ER // Am J Physiol Cell Physiol. — Т. 296. — (2009) С. C941—53. DOI:10.1152/ajpcell.00612. PMID 19279228.
↑ Alberts et al, 2007, p. 1123—1124
