
- •Змістовний модуль 4.
- •Питання 2. Метаморфоз та його гормональна регуляція
- •Питання 3. Нейроендокринна регуляція линьки хордових
- •Питання 4. Гормональна регуляція росту.
- •Питання 5. Механізми гуморальної регуляції в організмі
- •Використана література:
- •Питання 2. Шляхи апоптозу клітин
- •Питання 3. Молекулярні механізми апоптозу
- •Питання 4. Шляхи активації апоптозу
- •Питання 5. Апоптосома
- •Регуляція внутрішнього шляху білками родини Bcl-2
- •Питання 6. Апоптоз у рослин
- •Тема 3. Молекулярні основи старіння
- •Питання 1. Загальна характеристика старіння як процесу та його основні характеристики. Біологічний та календарний вік.
- •Календарний та біологічний вік
- •Питання 2.
- •Питання 3.
- •Питання 4. Процеси антистаріння (вітаукта). Тривалість життя та експериментальні способи її продовження
- •Питання для самоперевірки та контролю засвоєння знань
Питання 2. Шляхи апоптозу клітин
За ініціюючими частинами розрізняють такі шляхи апоптозу:
Рецептори апоптозу - група білків CD95 (Apo-1 абоFas) і TNF-R (фактор пухлинного некрозу). TNF-альфа - високо цитотоксична молекула, використовувалась як ліки проти раку. TNF-R1 - рецептор широко поширений і тому не може бути вибірковим. Інші представники цієї групи мають домен клітинної смерті (DD death domain) - домен білок-білкової взаємодії, що зв'язується з білком адаптором, таким як FADD. Активація рецепторів апоптозу лігандами (наприклад, CD-95L і TNF-альфа приводить до активації каспази-8, запускаючи каскад реакцій апоптозу.
Мітохондріальний шлях. Мітохондрії виконують центральну роль в апоптозі, при цьому спостерігаєтьсяся збільшення проникності мітохондріальної мембрани. Баланс між про- і анти-апоптозними членами родини Bcl-2 регулюють вихід про-апоптозних речовин із мітохондрій, що приводять до запуску апоптоза, таких як AIF, ендонуклеаза G, Smac/DIABLO і цитохром C. Вивільнення цитохрома-С із мітохондрії призводить до утворення апоптосоми в цитоплазмі, яка активує каспазу-9 і запускає клітинну смерть.
Обидва шляхи призводять до активації каспаз і запуску каскада реакцій, які викликають загибель клітини.
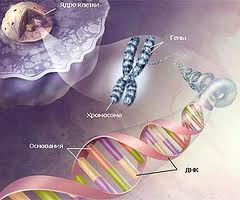
Рис. Структура генетичного апарату
Інтерфазна картина хромосом: В основі надхромосомної организації ядер у еукаріот лежить загальний периферичний розподіл інтерфазних хромосом поблизу ядерної мембрани з прикріпленням до неї ділянок хромосом, які несуть гетерохроматинові блоки. Місця прикріплення, як правило, пов'язані з особливою функціональною активністю тих чи інших ділянок генома. Асоційована з мембраною ДНК має більш високий рівень повторностей, ніж основна частина ядерної ДНК. Виявилось, в результаті апоптозу в першу чергу пошкоджується саме ця частина молекули ДНК, яка прилягає до ядерної мембрани.
Питання 3. Молекулярні механізми апоптозу
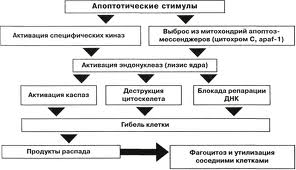
Апоптоз – багатоетапний процес.
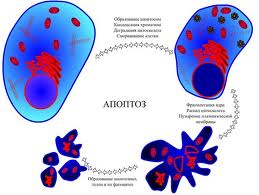
Рис. Загальна схема апоптозу
Перший етап – прийом сигнала, попередника смерті у вигляді інформації, яка поступає до клітини зовні або виникає в самій клітині. Сигнал сприймається рецептором і аналізується. Далі через рецептори або їх поєднання отриманий сигнал поступово передається молекулам-посередникам (месенджерам) різного порядку і в кінцевому результаті досягає ядра, де і проходить включення програми клітинної смерті шляхом активації летальних і/або репресії антилетальних генів. Проте існування ЗКС в безядерних системах (цитопластах – клітинах, позбавлених ядра) показує, що наявність ядра не є обов'язковим для реалізації процесу.

Рис. Прийом сигналу і подальша доля клітини
У більшості випадків апоптоз тваринних і людських клітин пов'язаний з протеолітичною активацією каскаду каспаз – група еволюційно консервативних цистеїнових протеаз, які специфічно расщеплюють білки по залишках аспарагінової кислоти. Вони містять цистеїнові залишки на своїх активних центрах.
На основі структурної гомології каспази поділяються на підродини:
а) каспази-1 (каспази 1, 4, 5),
б) каспази-2 (каспаза-2),
в) каспази-3 (каспази 3, 6–10).
Каспази можуть бути активовані двома шляхами: через рецептори апоптоза і мітохондрії. Перша відкрита каспаза - Ced-3 (Cell Death-3), виявлена у нематоди C. elegans. Мутація Ced-3 запобігала смерті 131 клітини в процесі нормального развитку нематоди. Гомолог Ced-3 у ссавців - інтерлейкін-1альфа-перетворюючий фермент ICE (interleicin converting enzime) був пізніше названий інгібітором каспази-1.
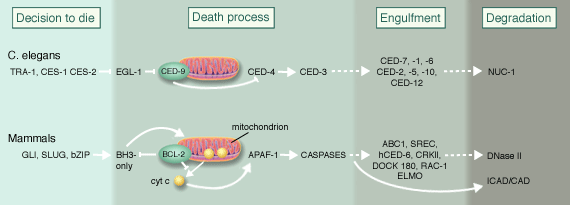
Рис. Порівняльний шлях проходження стадій апоптозу у аскариди ссавців.
Цистеїнові протеази, очевидно, беруть участь також у ЗКС рослин.
Проте апоптоз можливий і без участі каспаз: надсинтез білків-промоторів апоптоза Bax і Bak індукує ЗКС в присутності інгибіторів каспаз.
В результаті дії каспаз проходить:
1.активація прокаспаз з утворенням каспаз;
2.розщеплення антиапоптозних білків родини Bcl-2.
3.гідроліз білків ламінів.
Після активації каспаз апоптоз проходить двома шляхами:
Шлях ензиматичного перетравлення міжнуклеосомних проторів і нарізання фрагментів розміром 200 нуклеотидів. Більшість вчених підтримують думку, що апоптоз наступає в результаті ензиматичного распаду хроматина в ядрі клітини, при цьому ендонуклеази клітини починають розрізати молекулу ДНК з утворенням моно- и олігомерів. Нуклеазній атаці піддаються не тільки еухроматинові, але і спіралізовані ущільнені гетерохроматинові частини ядра. Для запуску цього клітина повинна продукувати ферменти - нуклеази, а для цього, в свою чергу, в клітині проходить посилення процесів транскрипції (біосинтез РНК) і трансляції (біосинтез білка). Є дані, що інгібітори білкового синтезу - циклогексамід і пуроміцин – попереджають ензиматичний роспад хроматину і можуть попередити процес апоптозу. Інгібітор ДНКази, відповідний за фрагментацію ДНК, піддається протеолізу. В нормальних клітинах апоптозна ДНКаза CAD (caspase-activated DNase) утворює неактивний комплекс з інгібітором CAD, позначений як ICAD. При апоптозі інгібітор ICAD з участю каспаз 3 або 7 інактивується, і вільна CAD, викликаючи межнуклеосомальні розриви хроматину, призводить до утворення
фрагментів ДНК з молекулярною масою, кратною молекулярній масі ДНК в
нуклеосомних частинках – 180-200 пар нуклеотидів.
Гетерохроматизація хроматину без розрізання ДНК[pиc]
1 ЕТАП – Дія на хроматин ядра нуклеазами і (або) ферментами конденсації
2 ЕТАП - Утворення фрагментів ДНК і (або) конденсація хроматину
3 ЕТАП - Резорбція хроматину (каріорексис и каріолізис)
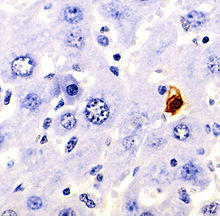
Рис. Виявлення фрагментації ДНК в апоптичних клітинах методом TUNEL Препарат тканини печінки миші, ядро апоптичної клітини має коричневе забарвлення, оптична мікроскопія.
Виявлений ядерний білок Acinus (apoptotic chromatin condensation inducer in the nucleus), із якого при комбінованій дії каспази-3 (протеоліз при Asp 1093) і не ідентифікованої протеази (протеоліз при Ser 987) утворюється фрагмент Ser 987 – Asp 1093. Цей фрагмент в присутності додаткових неядерних факторів викликає апоптолітичну конденсацію хроматина і фрагментацію ядра (каріорексис) без фрагментации ДНК.
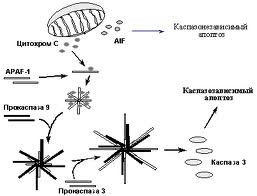
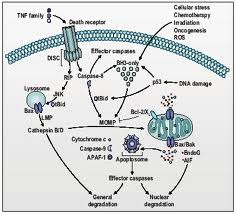
Рис. Каскад активації каспаз.
Відомо 14 каспаз, які поділя.ться на ініціатори, еффектори і стимулятори. Ініціатори (каспаза-8 і -9) розщеплюють і активують каспази еффектори (каспаза-3). Еффектори розщеплюють різні білки, що призводить до загибелі клітини. Активація каспаз призводить до запуску протеолітичного каскаду реакцій, які викликають загибель клітини. При цьому одні каспази активують інші - ампліфікація сигналу. Каспаза є тетрамером, що складається з двох великих (~20kDa) і двох малих (~10kDa) субодиниць. Велика і мала субодиниці утворюються в результаті розщеплення прокаспази. Каспаза містить два активні центри QACXG. Інгібуючий домен (DED або CARD) може бути вирізаний із каспази.
Ефекторні каспази активуються іншими каспазами (трансактивація). Ініціаторні каспази активуються автоактивацією, яка відбувається при взаємодії декількох прокаспаз (наприклад, прокаспаза-8 і DISC). Рецептор апоптозу сам по собі не володіє протеазною активністю. Активація каспаз веде до різних наслідків: каспаза-9 руйнує ядерні пори, що призводить до проникнення в ядро каспаз-3 і -7. Каспаза-3 розщеплює субодиницю ICAD, що інгібує, в двох місцях. Випуск CAD приводить до розщеплення ДНК між нуклеосомами. Каспази приводять до реорганізації цитоскелету і розпаду клітини на апоптозні тільця.
Каспази - родина цистеїнових протеїназ, головні еффектори апоптозу, існують в клітині як неактивні проформи і зимогени, які розщеплюються на активні форми ферментів, активуючи апоптоз. Ліганд -- рецептор смерті -- актівація ініціаторів каспаз (каспаза-8 -10) -- каскад активації інших каспаз - актівация каспаз-3 -6--инактивація клітинних структур.
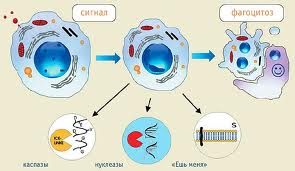
Руйнування клітинних структур при апоптозі
Фрагментація хромосомної ДНК - неактивний фермент CAD в комплексі з ICAD (інгібітор cad-чинник фрагментації ДНК) розщеплюється каспазою-3, вивільняючи CAD, розрізає ДНК нуклеосомома. Інактівація ферментів, залучених в репарацію ДНК - фермент полі (Adf-ribose) полімераза, або PARP- перший білок виявлений як субстрат для каспаз. PARP залучається до репарації ДНК і каталізує синтез (Adf-ribose) і закріплює на ланцюзі ДНК, руйнуюючи і змінюючи ядерні білки. Здатність PARP репарувати порушення розщепленням PARP каспазою-3.
Інактивація білків, втягнених в реплікацію. Каспази можуть інактивувати ДНК топоізомеразу II, сприяючи руйнуванню ДНК.
Руйнування структурних ядерних білків. Каспаза-6 руйнує ламіни, руйнуючи ядро, що приводить до конденсації хромосом. Чутливість клітин до стимул-реакцій змінюється залежно від експресії про- і анті-апоптозних білків (Bcl-2 білок інгібітору), складності стумулів і стадії клітинного циклу. Далі проходить розпад клітини на везикули, перехід фосфатіділсерину з внутрішнього моношару цитоплазматичної мембрани в зовнішній моношар, зменшення об'єму клітки, зморщування цитоплазматичної мембрани, конденсація ядра (апоптозні тільця), що фагоцитуються макрофагами і клітинами-сусідами.
Иніціатори апоптозу
Зовнішні сигнали (зв'язування ліганда, що індукує смерть рецептором на клітинній поверхні), швидкий варіант, а гранзім B може доставлятися в клітини цитотоксичними T-лімфоцитами, коли вони впізнають інфіковану клітину, активує каспази-3, 7, 8 і 10. Клітинний стрес – радіація, хімікалії, вірусна інфекції, недолік факора росту, оксидазний стрес (кількість bcl-2 білків визначає кількість стресу, необхідного для запуску а. Якщо мітохондрії не справляються з видаленням активних форм O2, останні ініціюють відкриття пор у зовнішній мембрані і вихід в цитозоль білка, що відповідає за каскад реакцій, які приводять до синтезу протеаз, нуклеаз.
Мітохондрія може бути ключовим регулятором каспазного каскаду і апоптозу - позбавлення від цитохрому-З в мітохондрії може вести до активації каспази 9 і потім каспази 3. Цей ефект досягається через утворення апоптосоми – мультипротеїнового комплексу, що включає цитохром C, Apaf-1, прокаспазу 9 і АТФ.
