
- •Предисловие
- •1. Уравнение состояния идеального газа Пример типовой задачи
- •Решение
- •Решение
- •Варианты задач
- •2. Основное уравнение молекулярно - кинетической теории газов (уравнение клаузиуса) Пример типовой задачи
- •Исходные данные
- •3. Распределение молекул по энергиям Примеры типовых задач
- •Решение
- •Решение
- •Исходные данные
- •4. Явления переноса Пример типовой задачи
- •5. Первое начало термодинамики и его применение к изопроцессам Пример типовой задачи
- •Исходные данные
- •6. Адиабатный процесс Пример типовой задачи
- •Произведем вычисления:
- •Исходные данные
- •Второе начало термодинамики Пример типовой задачи
- •Решение
- •Исходные данные
- •Основные физические постоянные
- •Международная система измерения (система си)
- •Некоторые приставки для преобразования внесистемных единиц в систему си
- •Эффективный диаметр молекул газов (нм)
- •Периодическая таблица д.И. Менделеева
- •Литература
- •Владимир Васильевич Довгаленко
2. Основное уравнение молекулярно - кинетической теории газов (уравнение клаузиуса) Пример типовой задачи
Найти
число молекул в 1 см3
водорода, если давление газа равно
2,67.104
Па, а средняя квадратичная скорость его
молекул при данных условиях равна 2400
![]() .
.
Д ано:Решение
ано:Решение
р
В
условиях задачи концентрацию молекул
можно найти двумя способами:
1.
Используем основное уравнение
кинетической теории
где
![]() .
.
![]() =
2400
=
2400
![]()
V = 1 см3 = 10–6 м3
=
2.10-3
![]()
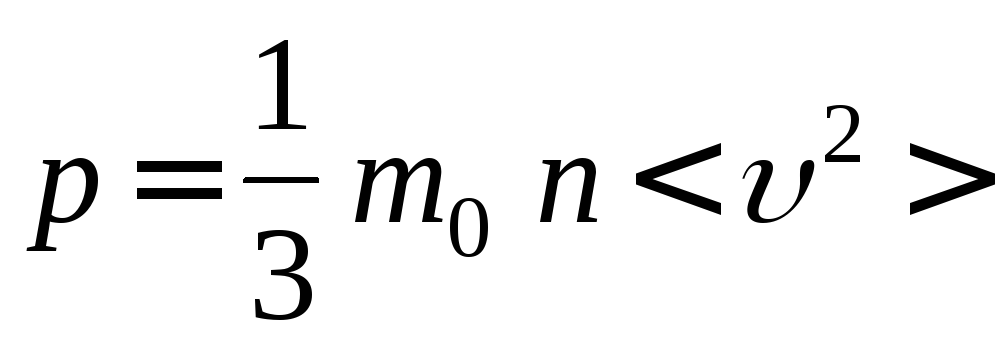 ,
,
N - ? где
- ? где
![]() .
.
Отсюда
![]() .
(1)
.
(1)
Массу
молекулы
![]() найдем, зная молярную массу и число
Авогадро:
найдем, зная молярную массу и число
Авогадро:
![]() .
.
Подставляем в формулу (1):
![]() .
.
Вычисляем концентрацию молекул:
![]() =
4,2 .
1024
м –3.
=
4,2 .
1024
м –3.
Тогда число молекул N = n . V = 4,2 . 1018 (молекул).
2. Используя связь давления с концентрацией и формулу средней квадратичной скорости
![]()
Получаем ту же формулу для вычисления п.
Ответ: N = 4,2 . 1018 молекул содержится в 1 см3.
Данные
вариантов задач представлены в табл.
1, где m
– масса газа; n
– концентрация молекул газа; V,
р,
T
– объем, давление температура газа
соответственно; N
– число молекул газа;
![]() –
средняя кинетическая энергия
поступательного движения одной молекулы;W
– суммарная кинетическая энергия
поступательного движения всех молекул;
–
средняя кинетическая энергия
поступательного движения одной молекулы;W
– суммарная кинетическая энергия
поступательного движения всех молекул;
![]() –
средняя квадратичная скорость молекул
газа;
–
средняя квадратичная скорость молекул
газа;![]() –
плотность газа.
–
плотность газа.
Таблица 1
Исходные данные
|
Вари ант |
Газ |
m, кг |
n, м-3 |
р, Па |
V, м3 |
Т, К |
N |
Дж |
W, Дж |
υкв, м/с |
ρ, кг/м3 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
1 |
N2 |
- |
2,7·1025 |
? |
4·10-3 |
- |
? |
? |
? |
400 |
- |
|
2 |
H2 |
3 |
- |
- |
- |
120 |
? |
? |
? |
- |
- |
|
3 |
H2 |
- |
1025 |
? |
- |
300 |
- |
? |
- |
- |
- |
|
4 |
газ |
- |
- |
5·105 |
2·10-3 |
- |
- |
- |
? |
- |
- |
|
5 |
O2 |
2·10-3 |
? |
106 |
- |
300 |
? |
- |
? |
- |
- |
|
6 |
газ |
- |
2·1025 |
? |
- |
? |
- |
1,6·10-20 |
- |
- |
- |
|
7 |
He |
1 |
? |
6·105 |
3·10-3 |
- |
? |
- |
? |
- |
- |
|
8 |
N2 |
- |
- |
- |
- |
- |
- |
? |
- |
450 |
- |
Окончание табл. 1
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
9 |
H2 |
10-2 |
- |
- |
- |
280 |
? |
? |
? |
- |
- |
|
10 |
Н2 |
2 |
? |
? |
2 |
- |
- |
? |
- |
2000 |
- |
|
11 |
N2 |
- |
? |
7·104 |
- |
- |
- |
? |
- |
400 |
- |
|
12 |
газ |
- |
1026 |
106 |
- |
? |
- |
? |
- |
- |
- |
|
13 |
N2 |
- |
- |
103 |
10-3 |
- |
? |
? |
? |
500 |
- |
|
14 |
O2 |
10-2 |
? |
? |
3·10-3 |
273 |
- |
? |
? |
- |
- |
|
15 |
N2 |
- |
- |
2·106 |
- |
- |
- |
3·10-20 |
- |
- |
? |
|
16 |
H2 |
- |
? |
? |
- |
290 |
- |
? |
- |
- |
4,1 |
|
17 |
He |
8·10-4 |
- |
- |
- |
240 |
- |
- |
? |
- |
- |
|
18 |
O2 |
- |
? |
- |
2·10-3 |
450 |
- |
? |
2600 |
- |
? |
|
19 |
H2 |
3·10-3 |
- |
- |
- |
- |
- |
? |
? |
420 |
- |
|
20 |
O2 |
5 |
? |
? |
10-3 |
- |
- |
- |
- |
350 |
- |
|
21 |
воздух |
10-3 |
3·1025 |
- |
- |
273 |
? |
? |
? |
? |
? |
|
22 |
O2 |
- |
? |
2·105 |
- |
- |
- |
? |
- |
1400 |
? |
|
23 |
газ |
- |
- |
5·102 |
4·10-3 |
- |
- |
- |
? |
- |
- |
|
24 |
газ |
10-3 |
- |
105 |
- |
273 |
? |
- |
? |
461 |
- |
|
25 |
O2 |
10-2 |
? |
- |
3·10-3 |
300 |
- |
- |
? |
- |
- |
|
26 |
N2 |
? |
3,7·1025 |
? |
2·10-3 |
- |
? |
? |
? |
400 |
- |
|
27 |
H2 |
4 |
2·1025 |
- |
- |
180 |
? |
- |
- |
? |
? |
|
28 |
N2 |
- |
? |
4·104 |
- |
- |
- |
? |
- |
700 |
? |
|
29 |
He |
6·10-4 |
- |
- |
- |
340 |
? |
- |
? |
- |
- |
|
30 |
газ |
10-3 |
- |
105 |
- |
373 |
? |
- |
? |
460 |
- |
Примечание:
молярная масса воздуха
![]() .
.
