
- •Глава 1 Основні поняття термодинаміки
- •1.1 Термодинамічна система
- •1.2 Фаза
- •1.3 Компонент
- •1.4 Термодинамічні параметри стану системи
- •1.5 Термодинамічний потенціал системи
- •1.6 Хімічний потенціал атомів компонентів
- •1.7 Рівновага в гетерогенній системі
- •1.8 Правило фаз Гіббса
- •1.9 Фазовий простір Гіббса
- •Глава 2 аналіз діаграм фазових рівноваг у подвійних системах
- •2.1 Діаграми стану з необмеженою розчинністю компонентів у твердій і рідкій фазах
- •2.1.1 Двокомпонентна система
- •2.2 Діаграми фазових рівноваг в системах з обмеженою розчинністю компонентів у твердих фазах
- •2.2.1 Діаграма стану з евтектичною рівновагою фаз
- •2.2.2 Діаграма стану з перитектичною рівновагою фаз
- •2.3 Діаграми стану з поліморфізмом компонентів
- •2.3.1 Однокомпонентна система
- •2.3.2 Двокомпонентна діаграма стану з поліморфізмом одного компоненту
- •2.3.3 Діаграма стану з евтектоїдною рівновагою фаз
- •2.4 Діаграми стану з проміжними фазами
- •2.5 Використання принципів термодинаміки незворотних процесів до аналізу фазових переходів в реальних системах
2.5 Використання принципів термодинаміки незворотних процесів до аналізу фазових переходів в реальних системах
Основні положення класичної термодинаміки, що розглянуті у попередніх розділах, описують закономірності, які виникають в системі при встановленні рівноваги. При цьому, як підкреслювалося раніше, будь-яка точка системи характеризується постійними температурою і тиском. Гетерогенна система, окрім цього, характеризується рівністю хімічного потенціалу атомів даного компоненту в усіх фазах.
Відмінною особливістю основних законів термодинаміки є відсутність в них параметру часу і похідних незалежних параметрів стану у часі. Це й зрозуміло: стани рівноваги мають властивості не змінюватися до тих пір, доки зовнішні умови є незалежними. Саме цьому класична термодинаміка, яка розглядає лише рівноважні, класичні ситуації, не надає можливості проведення фізико-хімічного аналізу процесів фазових переходів і є, по-суті, термостатикою.
В останні десятиріччя були зроблені багато чисельні спроби побудови термодинаміки незворотних процесів. У дійсний час розвивається декілька підходів до опису динаміки процесу фазових переходів. В них використовуються різні за своєю природою простори уявлень. Один з них – фазовий простір Гіббса – обговорювався раніше. Можливими є й інші простори уявлень – простір «подій», простір «імпульсу і енергії», простір «станів», простір «станів і енергії» і інші. Частина цих просторів – скалярні, інші – векторні. Еволюція системи при фазовому переході описується деякою єдиною траєкторією фігуративної точки. Параметри траєкторії задаються конкретними умовами процесу.
Один з найважливіших напрямків розвитку термодинаміки незворотних процесів базується на останніх досягненнях макроскопічної теорії явищ переносу 3. До цих досягнень відносять феноменологічні (тобто експериментально встановлені) закони:
закон теплопровідності Фур’є

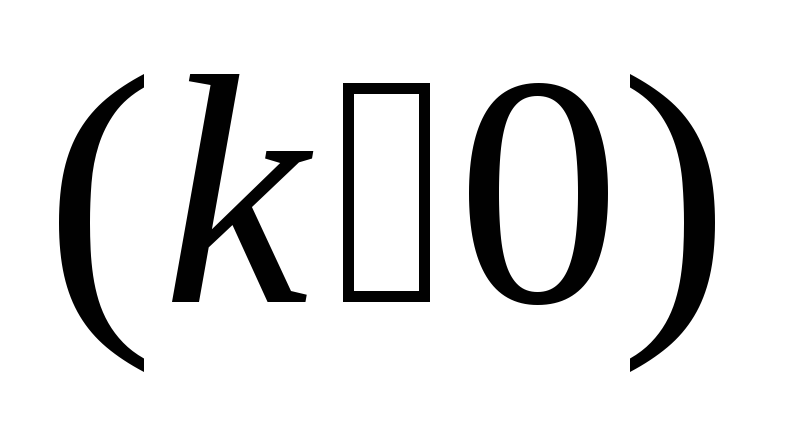 про пропорційність теплового потоку
градієнту температури;
про пропорційність теплового потоку
градієнту температури;закон дифузій Фіка
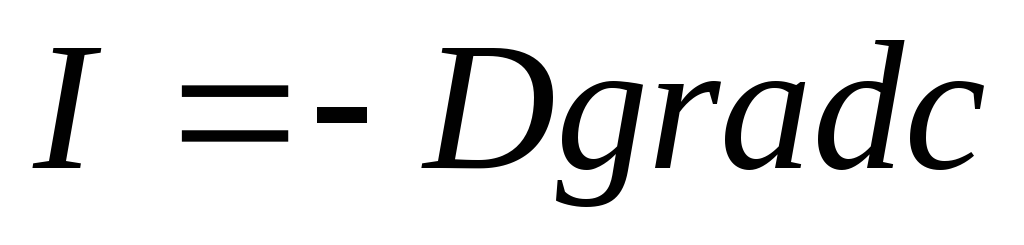
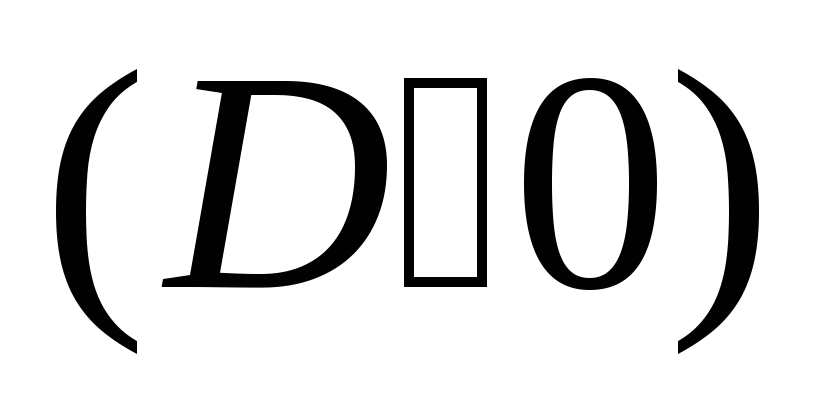 про пропорційність потоку атомів
компоненту градієнту концентрації;
про пропорційність потоку атомів
компоненту градієнту концентрації;закон Ома
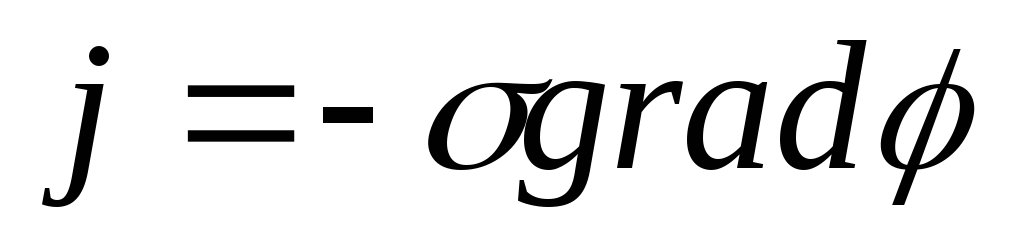 про пропорційність щільності токуj
градієнту потенціалу ;
про пропорційність щільності токуj
градієнту потенціалу ;закон Ньютона
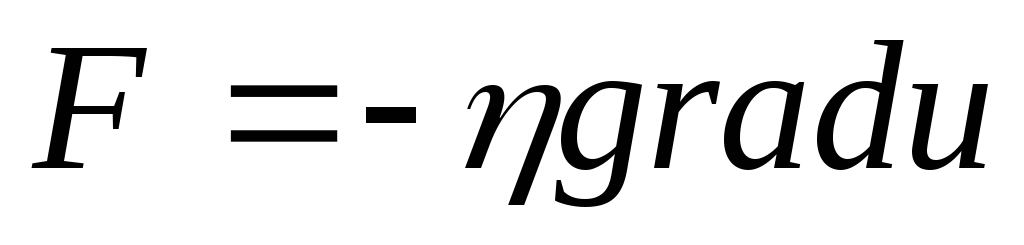 про пропорційність сили внутрішнього
тертяF
градієнту
швидкості u
і т.і.
про пропорційність сили внутрішнього
тертяF
градієнту
швидкості u
і т.і.
Причини, що викликають незворотні явища, носять назву «сили» і позначаються через Хі (і=1, 2, …): градієнт температури, градієнт концентрації і т.д. Кількісні характеристики незворотних явищ, що викликані силами Хі, називаються «потоками» Ii (i=1, 2, …): потік теплоти, потік атомів, що дифундують, і т. ін.
Фізичні потоки представляють собою швидкості зміни відповідних параметрів стану (температури, концентрації і т. ін.).
Як бачимо, в термодинаміці незворотних процесів параметр «швидкість» враховує фактор часу.
Грунтуючись на законах класичної термодинаміки і явищ переносу, термодинаміка незворотних процесів базується на трьох основних принципах.
1. Стан локально рівноважних частин системи визначається основним рівнянням термодинаміки для квазистатистичних процесів:
![]() (19)
(19)
Загальна
зміна ентропії системи аддитивно
складується зі змін в окремих її частинах.
Локальна швидкість виникнення ентропії
має вигляд
![]() ,
деIi
– потік; Хі
– сила.
,
деIi
– потік; Хі
– сила.
2. Потік Ii, що викликаний дією сил Хк –, є пропорційним цим силам:
![]()
![]() (і=1,
2, … n) (20)
(і=1,
2, … n) (20)
Коефіцієнти Lik називають класичними.
3. При відповідному виборі потоків Ii та Хі матриця кінетичних коефіцієнтів є симетричною (співвідношення взаємності Онзагера):
![]() (i,
k=1,
2, … n) (21)
(i,
k=1,
2, … n) (21)
Це означає, що якщо градієнт температури викликає градієнт концентрації, то й градієнт концентрації при деякому процесі викликає градієнт температури.
Наведені три принципи термодинаміки незворотних процесів утворюють самоузгоджену систему рівнянь для визначення спряжених потоків Ii та Хі.
Аналіз фазових переходів з допомогою принципів термодинаміки незворотних процесів базується поперед усього на понятті локальної рівноваги. Відомо, час встановлення термодинамічної рівноваги зростає зі збільшенням розміру системи. Тому можна вважати, що в малих макроскопічних об’ємах рівновага встановлюється значно раніше, ніж між цими об’ємами. З цього виходить, що хоча система в цілому і не знаходиться в рівновазі, в невеличких частинах її рівновага вже встановилася при певних параметрах: температурі, тиску, хімічному потенціалі атомів компонентів. При цьому важливо, щоб в малих частинах системи було ще багато часток, а також щоб відхилення від рівноваги були невеликими.
Конкретизуємо
ці положення на прикладі розглядання
фазового переходу
![]() .
Знаючи вихідний склад материнської
фази
.
Знаючи вихідний склад материнської
фази
![]() при температурі Т1,
а також рівноважні концентрації обох
фаз
при температурі Т1,
а також рівноважні концентрації обох
фаз
![]() і
і![]() при температурі Т2
(знаходяться на діаграмі стану), можна
знайти напрямок та величину потоку
дифузії атомів компонентів. Для цього
припустимо, що рівноважні значення
концентрацій для фаз
при температурі Т2
(знаходяться на діаграмі стану), можна
знайти напрямок та величину потоку
дифузії атомів компонентів. Для цього
припустимо, що рівноважні значення
концентрацій для фаз
![]() і
і![]() при Т2
(температурі фазового переходу)
встановилися тільки в невеликих об’ємах
цих фаз, які примикають до фазової
границі
при Т2
(температурі фазового переходу)
встановилися тільки в невеликих об’ємах
цих фаз, які примикають до фазової
границі
![]() .
.
Оскільки
процес фазового переходу продовжується
невеликий час, очевидно, що ділянки
материнської
![]() -фази,
які віддалені від границі
-фази,
які віддалені від границі![]() ,
ще не встигли змінити концентрацію.
,
ще не встигли змінити концентрацію.
Таким
чином, у припущенні, що дифузія в системі
є вирівнюючою і з врахуванням знаку
нерівності
![]() з’являється можливість визначити
напрямок дифузії атомів компоненту Б
в
з’являється можливість визначити
напрямок дифузії атомів компоненту Б
в![]() -фазі,
а обчисливши
-фазі,
а обчисливши![]() (у припущенні, що відома величинаD
при даній Т2)
– визначити величину дифузійного потоку
І атомів компоненту Б.
(у припущенні, що відома величинаD
при даній Т2)
– визначити величину дифузійного потоку
І атомів компоненту Б.
При цьому можливі два випадки.
1.
Дифузійний потік І атомів компоненту
Б в
![]() -фазі
направлений до границі
-фазі
направлений до границі![]() (
(![]() -фаза
побудована в основному з атомів компоненту
Б). Пересичення
-фаза
побудована в основному з атомів компоненту
Б). Пересичення![]() -фази
компонентами Б, що виникає, приводить
до пересування
-фази
компонентами Б, що виникає, приводить
до пересування![]() границі всередину
границі всередину![]() -фази,
тобто приведе до росту кристалів
-фази,
тобто приведе до росту кристалів![]() -фази.
-фази.
2.
Дифузійний потік І атомів компоненту
Б в
![]() -фазі
направлений від границі
-фазі
направлений від границі![]() .
У результаті склад
.
У результаті склад![]() -фази
на границі
-фази
на границі![]() обідниться по відношенню до рівноважного.
Для підтримання рівноваги атоми Б з
обідниться по відношенню до рівноважного.
Для підтримання рівноваги атоми Б з![]() -фази
будуть переходити до
-фази
будуть переходити до![]() -фази
до тих пір, доки рівноважна концентрація
-фази
до тих пір, доки рівноважна концентрація![]() -фази
на між фазній границі не відновиться.
Природно, що це приведе до часткового
розчинення кристалів
-фази
на між фазній границі не відновиться.
Природно, що це приведе до часткового
розчинення кристалів![]() -фази.
-фази.
Описана
схема аналізу фазового переходу
![]() дозволяє не тільки визначити стимулюючий
направлену дифузію атомів компонентів
градієнт концентрації як рушійну силу
процесу, а й спрогнозувати кінцевий
результат процесу (розчинення або
виділення
дозволяє не тільки визначити стимулюючий
направлену дифузію атомів компонентів
градієнт концентрації як рушійну силу
процесу, а й спрогнозувати кінцевий
результат процесу (розчинення або
виділення![]() -фази).
-фази).
