
- •Глава 1 Основні поняття термодинаміки
- •1.1 Термодинамічна система
- •1.2 Фаза
- •1.3 Компонент
- •1.4 Термодинамічні параметри стану системи
- •1.5 Термодинамічний потенціал системи
- •1.6 Хімічний потенціал атомів компонентів
- •1.7 Рівновага в гетерогенній системі
- •1.8 Правило фаз Гіббса
- •1.9 Фазовий простір Гіббса
- •Глава 2 аналіз діаграм фазових рівноваг у подвійних системах
- •2.1 Діаграми стану з необмеженою розчинністю компонентів у твердій і рідкій фазах
- •2.1.1 Двокомпонентна система
- •2.2 Діаграми фазових рівноваг в системах з обмеженою розчинністю компонентів у твердих фазах
- •2.2.1 Діаграма стану з евтектичною рівновагою фаз
- •2.2.2 Діаграма стану з перитектичною рівновагою фаз
- •2.3 Діаграми стану з поліморфізмом компонентів
- •2.3.1 Однокомпонентна система
- •2.3.2 Двокомпонентна діаграма стану з поліморфізмом одного компоненту
- •2.3.3 Діаграма стану з евтектоїдною рівновагою фаз
- •2.4 Діаграми стану з проміжними фазами
- •2.5 Використання принципів термодинаміки незворотних процесів до аналізу фазових переходів в реальних системах
1.6 Хімічний потенціал атомів компонентів
Хімічним
потенціалом i-компоненту
![]() Дж. Гіббс назвав похідну
Дж. Гіббс назвав похідну
![]() ,
(12)
,
(12)
де S, V, nj – незалежні перемінні: відповідно ентропія, об’єм, число молей компонентів.
Щоб більш наглядно уявити собі сенс хімічного потенціалу атомів і-компоненту, врахуємо, що згідно першої фундаментальної термодинамічної теореми для відкритих систем, повний диференціал внутрішньої енергії для випадку, коли незалежними перемінними є S, V і nj,
![]() (13)
(13)
У
цьому рівнянні усі три похідні внутрішньої
енергії по незалежних параметрах є
узагальненими силами, або факторами
інтенсивності. Іншими словами,
![]() у (12) є фактором інтенсивності, що визначає
процес перерозподілу числа молей
компонентів у системі. Таким чином,
хімічний потенціал при перерозподілі
мас компонентів між фазами при фазовому
переході відіграє таку саму роль, що і
тиск при зміні об’єму або температура
у процесі теплообміну.
у (12) є фактором інтенсивності, що визначає
процес перерозподілу числа молей
компонентів у системі. Таким чином,
хімічний потенціал при перерозподілі
мас компонентів між фазами при фазовому
переході відіграє таку саму роль, що і
тиск при зміні об’єму або температура
у процесі теплообміну.
1.7 Рівновага в гетерогенній системі
Рівновага у багатофазній системі наступає при
![]()
![]() (14)
(14)
![]()
де
![]() - фази системи; i - індекс компонента. При
рівності температур і тисків в усіх
точках системи умовою рівноваги фаз є
рівність хімічних потенціалів атомів
компонентів в усіх фазах системи:
- фази системи; i - індекс компонента. При
рівності температур і тисків в усіх
точках системи умовою рівноваги фаз є
рівність хімічних потенціалів атомів
компонентів в усіх фазах системи:
![]() (15)
(15)
1.8 Правило фаз Гіббса
Отримані умови рівноваги гетерогенної системи дозволяють визначити кількість фаз, що здатні одночасно знаходитися у рівновазі, або число незалежних параметрів гетерогенної системи (число термодинамічних ступенів свободи системи С), які можна змінювати без порушення її рівноваги. Цю задачу вирішив Дж. Гіббс і її результат називається правилом Гіббса.
Розгорнемо умову фазової рівноваги (15) для кожного компонента:
![]()
![]() (16)
(16)
![]() .
.
Як відомо, хімічні потенціали представляють собою функції температури, тиску і концентрації. Тому рівності (16) представляють собою рівняння, що зв’язують усі незалежні параметри, які визначають стан системи. У кожній строчці міститься Ф - 1 рівнянь, а число усіх строчок – K, отже, число рівнянь дорівнює (Ф – 1)K.
У рівняннях (14) не усі змінні у дійсності є незалежними. Як виходить з курсу математики, число незалежних змінних дорівнює різниці між числом усіх змінних і числом рівнянь. Отже, число незалежних змінних або число термодинамічних ступенів свободи системи:
![]() (17)
(17)
У тому випадку, якщо аналіз проводиться при постійному тиску:
![]() (18)
(18)
Якщо число термодинамічних ступенів свободи дорівнює нулю, це означає, що жодний з термодинамічних параметрів системи, які визначають стан системи, не може бути змінений без порушення рівноваги.
1.9 Фазовий простір Гіббса
Умови існування окремих фаз у даній системі, а також умови співіснування декількох фаз (багатофазні рівноваги) зручно описувати і аналізувати з допомогою геометричних образів. При цьому, згідно засадничих ідей Дж. Гіббса, кожному окремому стану, у якому знаходиться система, відповідає цілком визначена на площині або в об’ємі. В якості координат цієї точки, яку називають фігуративною або нодою, вибирають незалежні термодинамічні параметри системи – температуру, тиск, концентрацію. Виявляється, що в такого роду пласкому або тривимірному просторі у деякому інтервалі зміни незалежних параметрів стану фігуративні точки описують один й той самий випадковий стан або навіть одну й ту саму фазу.
Приклад 1. Для однокомпонентної системи фазовий простір будується в координатах температура – тиск. Згідно наведеної на рисунку 2 діаграми стану, усі фігуративні точки, що знаходяться вище і лівіше від лінії 1-1, описують a- стан системи, в якому стійкою є a-фаза. Усі точки, що знаходяться нижче і правіше від лінії 1-1, описують область стійкості b-фази. Границя 1-1 цих двох фазових просторів описує умови рівноваги двох a- та b-фаз.
В принципі ці умови можна виразити з допомогою методів аналітичної геометрії.

Рисунок 2 – Діаграма фазових рівноваг в однокомпонентній системі
Приклад 2. У двохкомпонентній системі фазовий простір будується в координатах тиск – температура – концентрація і представляє собою деякий об’єм. Однак на практиці металургійного виробництва процеси найчастіше усього відбуваються при атмосферному або близькому до нього тиску. Тому, приймаючи для простоти тиск величиною постійною, фазовий простір зручно будувати у двох координатах: концентрація-температура.
Як виходить з діаграми стану, що наведена на рис. 3, фазовий простір системи А-В розділений на дві області: вище за криву a-c-b – область стійкості a-фази і нижче за лінію a-d-b – область стійкості b-фази.
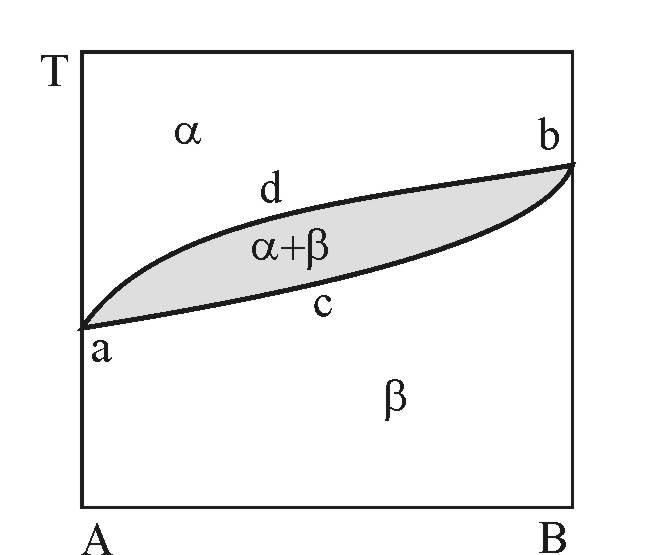
Рисунок 3 – Діаграма фазових рівноваг у двокомпонентній системі А – В
Нескладно побачити, що область перетину a- і b-фазових просторів (затемнена) утворює двофазну (a+b) область і описує умови двофазної (a+b) рівноваги.
