
- •Глава 1 Основні поняття термодинаміки
- •1.1 Термодинамічна система
- •1.2 Фаза
- •1.3 Компонент
- •1.4 Термодинамічні параметри стану системи
- •1.5 Термодинамічний потенціал системи
- •1.6 Хімічний потенціал атомів компонентів
- •1.7 Рівновага в гетерогенній системі
- •1.8 Правило фаз Гіббса
- •1.9 Фазовий простір Гіббса
- •Глава 2 аналіз діаграм фазових рівноваг у подвійних системах
- •2.1 Діаграми стану з необмеженою розчинністю компонентів у твердій і рідкій фазах
- •2.1.1 Двокомпонентна система
- •2.2 Діаграми фазових рівноваг в системах з обмеженою розчинністю компонентів у твердих фазах
- •2.2.1 Діаграма стану з евтектичною рівновагою фаз
- •2.2.2 Діаграма стану з перитектичною рівновагою фаз
- •2.3 Діаграми стану з поліморфізмом компонентів
- •2.3.1 Однокомпонентна система
- •2.3.2 Двокомпонентна діаграма стану з поліморфізмом одного компоненту
- •2.3.3 Діаграма стану з евтектоїдною рівновагою фаз
- •2.4 Діаграми стану з проміжними фазами
- •2.5 Використання принципів термодинаміки незворотних процесів до аналізу фазових переходів в реальних системах
Глава 2 аналіз діаграм фазових рівноваг у подвійних системах
Аналіз діаграм фазових рівноваг наводиться з метою встановлення:
- фазового складу сплаву даного складу при заданій температурі;
- рівноважної концентрації фаз за даних умов;
- співвідношення мас і об’ємів фаз, що знаходяться у рівновазі за даних умов;
- ступеню свободи системи при даних умов;
- граничних розчинностей атомів компонентів у даній фазі.
Розглянемо докладніше методику проведення аналізу на діаграмах фазових рівноваг кожного типу.
2.1 Діаграми стану з необмеженою розчинністю компонентів у твердій і рідкій фазах
2.1.1 Двокомпонентна система
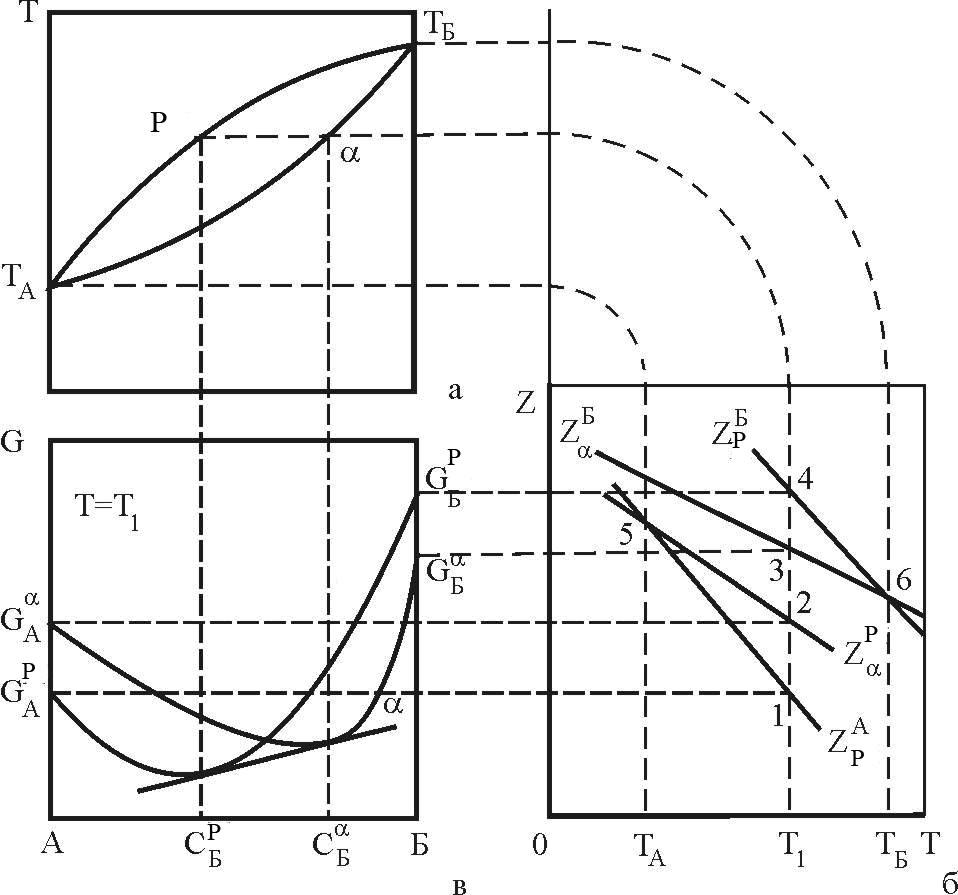
Розглянемо обумовленість взаємних положень фігуративних точок на фазовій діаграмі і кривих мольних вільних енергій чистих компонентів і відповідних подвійних сплавів системи А - Б (рис. 4).
Точка плавлення чистого компоненту А (точка 5, рис. 4, б) знаходиться на перетині кривих мольних вільних енергій рідкої (5-1) і твердої (5-2) фаз цього компоненту. Аналогічно знаходиться точка плавлення 6 компоненту Б.
Отримані точки проектуємо на температурну ось діаграми фазових рівноваг (рис. 4, а) і отримуємо точки ТА і ТБ відповідно.
Потім
знаходимо на рис. 4, б величини мольних
вільних енергій твердої і рідкої фаз
чистих компонентів при температурі Т1.
вони визначаються як точки 2, 1, 3, 4 перетину
відповідних кривих вільних мольних
енергій
![]() з ізотермою Т1. спроектуємо отримані
чотири точки на ось вільних енергій
діаграми G = f(c) - рис. 4, в.
з ізотермою Т1. спроектуємо отримані
чотири точки на ось вільних енергій
діаграми G = f(c) - рис. 4, в.
 ’
’
Рисунок 4 – Зв’язок кривих термодинамічного потенціалу компонентів, концентраційної залежності вільної енергії фаз з елементами діаграми стану в системі А – Б
Через
точки
![]() ,
,![]() ,
,![]() ,
,![]() на рис. 4, в проведемо криві мольних
вільних енергій твердої і рідкої фаз
подвійних сплавів у припущенні, що
однозначно відомий профіль кривих.
на рис. 4, в проведемо криві мольних
вільних енергій твердої і рідкої фаз
подвійних сплавів у припущенні, що
однозначно відомий профіль кривих.
Згідно
рівняння (16) рівновага твердої і рідкої
фаз досягається при рівності хімічних
потенціалів атомів компонентів, що
утворюють ці фази:
![]() і
і![]() .
Тому, щоб знайти величини рівноважних
концентрацій співіснуючих фаз при Т=T1,
достатньо у відповідності з рівнянням
(12) провести графічне диференціювання,
тобто знайти загальну дотичну до кривих
.
Тому, щоб знайти величини рівноважних
концентрацій співіснуючих фаз при Т=T1,
достатньо у відповідності з рівнянням
(12) провести графічне диференціювання,
тобто знайти загальну дотичну до кривих
![]() і
і![]() .
Точки дотику визначать концентрації
фазa
і Р, що знаходяться в рівновазі.
Спроектувавши ці точки на ізотерму T1
фазового простору діаграми стану
(рис. 4, а), отримаємо точки L1
і S1,
що належать, як видно на рисунку, кривим
ліквідус і солідус відповідно.
.
Точки дотику визначать концентрації
фазa
і Р, що знаходяться в рівновазі.
Спроектувавши ці точки на ізотерму T1
фазового простору діаграми стану
(рис. 4, а), отримаємо точки L1
і S1,
що належать, як видно на рисунку, кривим
ліквідус і солідус відповідно.
Якщо повторити викладена для T = T1 побудова для більшості інших температур T2, T3, … , Tn можна показати, що сімейства точок L2, L3, …, Ln і S2, S3, …, Sn, побудують криві ліквідус і солідус.
Розглянемо тепер більш докладно деякі геометричні залежності на діаграмі стану (рис. 5).
Виберемо
сплав I, склад (концентрація компоненту
Б) якого буде описуватися довжиною
відрізку
![]() .
При зміні температури фігуративна точка
(нода) буде ковзати по прямій 1-2-3-4.
.
При зміні температури фігуративна точка
(нода) буде ковзати по прямій 1-2-3-4.
Як видно на рис. 5, фазовий простір діаграми складається з трьох фазових областей: двох однофазних (області рідкої фази і a-твердого розчину) і однієї двофазної (Р+a).
Таким чином, при T = T1 сплав I знаходиться в рідкому стані (стійка рідка фаза), при T3 і T4 - у твердофазному (стійка a-фаза). При T = T2 сплав I знаходиться у двофазному стані Р+a.
Для
визначення рівноважного складу a
і Р, що знаходяться в рівновазі, через
точку 2 проведемо ізотерму до перетину
з лініями ліквідус і солідус. Цей відрізок
![]() в геометричній термодинаміці називається
конодою.
в геометричній термодинаміці називається
конодою.
Склади
фаз, що знаходяться у рівновазі при T =
T2,
визначаються абсцисами точок 2I
і 2II:
склад твердої a-фази
– відрізком
![]() або відрізком
або відрізком![]() ,
рідкої фази – відрізком
,
рідкої фази – відрізком![]() або відрізком
або відрізком![]() .
.
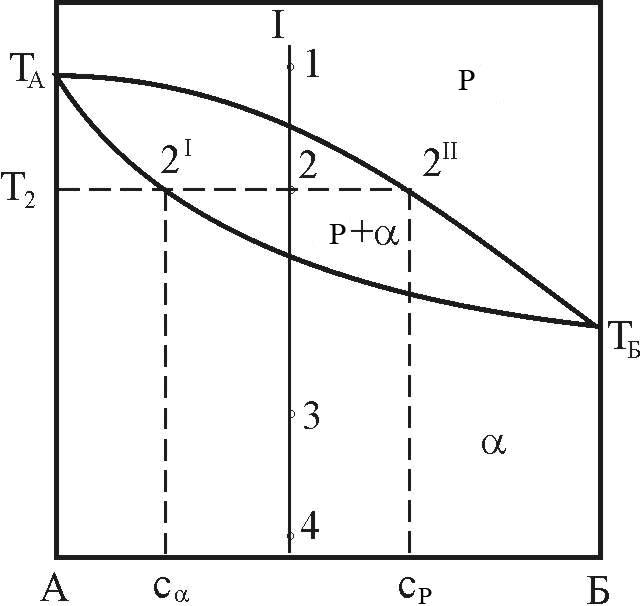
Рисунок 5 – Діаграма стану з необмеженою розчинністю компонентів у рідкій і твердій фазах
За допомогою коноди можна визначити співвідношення мас фаз, що знаходяться у рівновазі при даній температурі. Це можна зробити за допомогою нескладного правила, що іноді (переважно у підручниках старих видань) називають правилом ричага. Сутність цього у наступному: співвідношення мас є зворотно пропорційним відношенню відрізків коноди, на які ділить коноду фігуративна точка, що відповідає складу сплаву.
Наприклад,
при Т = T2
співвідношення мас твердої і рідкої
фаз, що знаходяться у рівновазі, зворотно
пропорційно співвідношенню відрізків
![]() і
і![]() тобто
тобто![]() .
.
Таким чином, для визначення співвідношення мас фаз слід користуватися шкалою масових відсотків.
Отже,
![]() ,
,![]() ,
,![]() .
.
Визначення варіантності (ступеню свободи) системи.
Для аналізу ступенів свободи системи при постійному тиску користуються формулою (18).
Отже, для однофазного стану двокомпонентної системи (коли в рівновазі знаходиться одна фаза a або рідка) C=2+1-1=2. Система є двоваріативною.
Якщо у рівновазі знаходяться дві (Р+a) фази, C=2+1–2 = 1, система є моноваріантною.
У випадку рівноваги трьох фаз C=0 (система не має ступенів свободи), вона є нонваріантною.
Визначення межової розчинності атомів компонентів у фазах.
Під межовою розчинністю атомів компонентів у фазах системи розуміють максимальну або мінімальну (або і максимальну і мінімальну) концентрації атомів компонентів у даній фазі, за яких сплав знаходиться ще в однофазному стані.
Наприклад,
межова (максимальна) розчинність атомів
Б в a-фазі
на рис. 5 визначиться лінією TА
– 2I
- TБ.
Насправді, збільшення концентрації
атомів Б понад цю величину (наприклад,
для Т=T2
понад
![]() )
зсуває фігуративну точку вправо, до
області двофазного (Р+a)
стану.
)
зсуває фігуративну точку вправо, до
області двофазного (Р+a)
стану.
З іншого боку, межова (у даному випадку мінімальна) концентрація атомів Б в рідкій фазі виділиться лінією TБ -2II -TA, тому її зменшення зсуває фігуративну точку лівіше за цю лінію і приводить сплав у двохфазний стан. Ця сама лінія може бути описана як лінія межової (максимальної) розчинності компоненту А в рідкій фазі, тому що подальше збільшення концентрації компоненту А в рідині викликає утворення "осаду" - кристалів a-фази, тобто приводить систему у двофазний стан.
Лінії межової розчинності у двокомпонентних системах називають лініями сольвусу.
