
- •Введение
- •Глава I. Химическая термодинамика
- •2. Теплоемкость идеального газа.
- •3. Теплоемкость твердых тел.
- •4. Правило Неймана - Коппа.
- •5. Температурная зависимость теплоемкости.
- •6. Квантовая теория теплоемкости
- •Глава III. Применение первого начала к химическим процессам
- •Термохимия – раздел термодинамики
- •2. Связь тепловых эффектов химических реакций при постоянном объеме (qv) и давлении (qp).
- •3. Закон Гесса.
- •4. Следствия из закона Гесса.
- •5. Зависимость теплового эффекта химической реакции от температуры (уравнение Кирхгофа).
- •Глава IV. Второе начало термодинамики.
- •Содержание второго начала термодинамики.
- •2. Обратимые и необратимые процессы.
- •3. Коэффициент полезного действия тепловой машины. Цикл Карно.
- •4. Работа холодильника (теплового насоса).
- •5. Измерение рассеивания энергии. Энтропия.
- •6. Термодинамический взгляд на энтропию.
- •7. Вычисление энтропии.
- •8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
- •9. Энергия Гиббса. Энергия Гельмгольца.
- •10. Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
- •11. Уравнение Гиббса - Гельмгольца.
- •12. Применение второго закона термодинамики к фазовым переходам. Уравнение Клаузиуса - Клапейрона.
- •13. Химическое равновесие. Закон действующих масс и константа равновесия.
- •14. Различные формы констант равновесия и связь между ними.
- •15. Уравнение изотермы химической реакции. Химическое сродство.
- •16. Направление реакций и условие равновесия.
- •17. Зависимость константы равновесия от температуры и давления.
- •18. Равновесие в гетерогенных системах.
- •19. Термическая диссоциация.
- •Глава V. Третий закон термодинамики.
- •Недостаточность I и II законов термодинамики для расчета химического сродства.
- •2. Тепловая теорема Нернста.
- •3. Следствия из тепловой теоремы Нернста.
- •4. Расчет абсолютных значений энтропии.
- •5. Применение таблиц термодинамических функций для расчетов равновесий.
- •Глава VI. Правило фаз.
- •1. Основные понятия и определения.
- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
2. Теплоемкость идеального газа.
Из молекулярно-кинетической теории следует, что кинетическая энергия (WК) 1 моля идеального газа равна:
![]() ,
(2.10)
,
(2.10)
где NA - число Авогадро, равное 6,02 1023 Дж/К.
Учитывая, что
![]() можно получить:
можно получить:
![]() .
(2.11)
.
(2.11)
Используя соотношение (2.8):
![]() .
(2.12)
.
(2.12)
Уравнения (2.11) и (2.12) представляют закон Дюлонга - Пти для идеальногогаза.
Если идеальный газ одноатомный, то i = 3 и тогда:
![]() .
(2.13)
.
(2.13)
Для двухатомного газа i = 5 и тогда:
![]() .
(2.14)
.
(2.14)
В случае трехатомного газа i = 6, поэтому:
СV = 3R; СР = 4R. (2.15)
3. Теплоемкость твердых тел.
Твердое тело можно представить в виде огромной молекулы, состоящей из отдельных атомов. Число атомов в 1 моле равно NA, тогда общее число степеней свободы – 3 NA и выражение для расчета теплоемкости принимает следующий вид:
![]() ,
(2.16)
,
(2.16)
причем СV
![]() СР.
СР.
Соотношение (2.16) – закон Дюлонга – Пти для твердых тел.
Оказалось, что для углерода, кремния и бора соотношение (2.16) не выполняется. Кроме того закон Дюлонга – Пти не учитывает температурную зависимость теплоемкости.
4. Правило Неймана - Коппа.
Из многочисленных эмпирических соотношений предлагавшихся для вычисления теплоемкостей твердых тел, наибольшее распространение имеет правило Неймана - Коппа, известное еще как правило аддитивности теплоемкости.
Это правило, сформулированное Нейманом в 1831 г. и Коппом в 1864 г., позволяет приблизительно вычислять теплоемкость химических соединений. Согласно этому правилу, молярная теплоемкость химических соединений в твердом состоянии равна сумме молярных теплоемкостей элементов, входящих в это соединение. Принимая во внимание правило Дюлонга - Пти, для соединения, состоящего из N атомов справедливо соотношение:
C = N(3R). (2.17)
Для приближенной оценки удельной теплоемкости сплава используется соотношение вида:
С = рС1 + qС2 + …, (2.18)
где С - удельная теплоемкость сплава;
р, q - массовые доли компонентов сплава;
С1, С2 - удельные теплоемкости компонентов сплава.
5. Температурная зависимость теплоемкости.
Теплоемкость изменяется с изменением температуры, причем величина этого изменения различна в различных температурных интервалах.
Качественно характер изменения С = f (Т) для большинства металлов, не испытывающих фазовых превращений в твердом состоянии представлен на рис. 2.1.
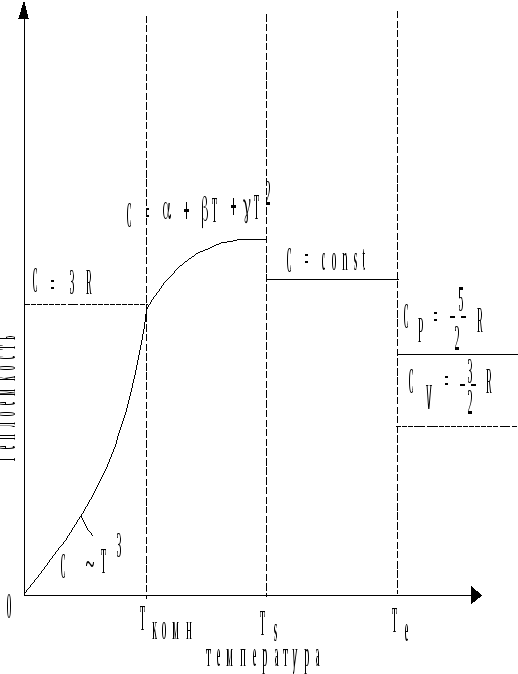

Рис. 2.1. Характер изменения теплоемкости с температурой.
Для металлов в
твердом состоянии в области низких
температур (T
< Tкомн.)
характерна зависимость отвечающая
уравнению кубической параболы:
![]() .
С понижением температуры теплоемкость
быстро уменьшается и при
.
С понижением температуры теплоемкость
быстро уменьшается и при![]() стремится принять нулевое значение. В
области комнатных температур (Ткомн.)
теплоемкость определяется из закона
Дюлонга - Пти. Дальнейшее повышение
температуры плавления (ТS)
вызывает непрерывное увеличение
теплоемкости. Этот температурный участок
представляет наибольший практический
интерес. Для него зависимость С = f
(Т) выражается с помощью эмпирических
соотношений, имеющих вид степенных
рядов:
стремится принять нулевое значение. В
области комнатных температур (Ткомн.)
теплоемкость определяется из закона
Дюлонга - Пти. Дальнейшее повышение
температуры плавления (ТS)
вызывает непрерывное увеличение
теплоемкости. Этот температурный участок
представляет наибольший практический
интерес. Для него зависимость С = f
(Т) выражается с помощью эмпирических
соотношений, имеющих вид степенных
рядов:
![]() ,
(2.18)
,
(2.18)
![]() ,
(2.19)
,
(2.19)
Теплоемкость для жидкого состояния (ТS - TE) характеризуется, как правило, меньшей величиной, чем для твердого состояния, причем не изменяющейся вплоть до температуры кипения (ТЕ).
Так как большинство металлов в газообразном состоянии - одноатомные газы, то их теплоемкости определяются из закона Дюлонга - Пти.
