
- •Введение
- •Глава I. Химическая термодинамика
- •2. Теплоемкость идеального газа.
- •3. Теплоемкость твердых тел.
- •4. Правило Неймана - Коппа.
- •5. Температурная зависимость теплоемкости.
- •6. Квантовая теория теплоемкости
- •Глава III. Применение первого начала к химическим процессам
- •Термохимия – раздел термодинамики
- •2. Связь тепловых эффектов химических реакций при постоянном объеме (qv) и давлении (qp).
- •3. Закон Гесса.
- •4. Следствия из закона Гесса.
- •5. Зависимость теплового эффекта химической реакции от температуры (уравнение Кирхгофа).
- •Глава IV. Второе начало термодинамики.
- •Содержание второго начала термодинамики.
- •2. Обратимые и необратимые процессы.
- •3. Коэффициент полезного действия тепловой машины. Цикл Карно.
- •4. Работа холодильника (теплового насоса).
- •5. Измерение рассеивания энергии. Энтропия.
- •6. Термодинамический взгляд на энтропию.
- •7. Вычисление энтропии.
- •8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
- •9. Энергия Гиббса. Энергия Гельмгольца.
- •10. Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
- •11. Уравнение Гиббса - Гельмгольца.
- •12. Применение второго закона термодинамики к фазовым переходам. Уравнение Клаузиуса - Клапейрона.
- •13. Химическое равновесие. Закон действующих масс и константа равновесия.
- •14. Различные формы констант равновесия и связь между ними.
- •15. Уравнение изотермы химической реакции. Химическое сродство.
- •16. Направление реакций и условие равновесия.
- •17. Зависимость константы равновесия от температуры и давления.
- •18. Равновесие в гетерогенных системах.
- •19. Термическая диссоциация.
- •Глава V. Третий закон термодинамики.
- •Недостаточность I и II законов термодинамики для расчета химического сродства.
- •2. Тепловая теорема Нернста.
- •3. Следствия из тепловой теоремы Нернста.
- •4. Расчет абсолютных значений энтропии.
- •5. Применение таблиц термодинамических функций для расчетов равновесий.
- •Глава VI. Правило фаз.
- •1. Основные понятия и определения.
- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
14. Различные формы констант равновесия и связь между ними.
 - константа равновесия, выраженная через
молярные концентрации веществ, участвующих
в химической реакции.
- константа равновесия, выраженная через
молярные концентрации веществ, участвующих
в химической реакции.
Кроме того константу равновесия можно выразить через парциальные давления реагирующих веществ:
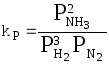 .
.
Константу равновесия можно выразить через числа молей веществ - участников реакции:
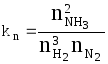 .
.
Константу равновесия можно выразить и через мольные доли участников реакции:
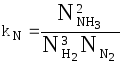 .
.
В общем случае kC
![]() kP
kP
![]() kn
kn
![]() kN,
но между ними существует связь. Для ее
установления целесообразно обратиться
к химической реакции, записанной в общем
виде:
kN,
но между ними существует связь. Для ее
установления целесообразно обратиться
к химической реакции, записанной в общем
виде:
![]() .
(4.87)
.
(4.87)
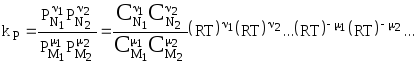 .
.
Откуда
![]() ,
(4.88)
,
(4.88)
где
![]() -
изменение количества вещества в
результате химической реакции.
-
изменение количества вещества в
результате химической реакции.
Для идеальных газов их парциальные давления связаны с общим давлением соотношением:
![]() ,
,
поэтому:
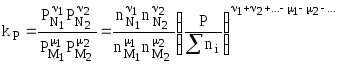
или
![]() .
(4.89)
.
(4.89)
Далее:
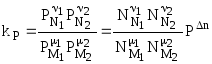
или окончательно:
![]() .
(4.90)
.
(4.90)
15. Уравнение изотермы химической реакции. Химическое сродство.
Для реакции (4.87) ход рассуждений, использованный в параграфе 12 в условиях V, T=const дает:
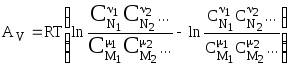 (4.91)
(4.91)
или сокращенно
![]() ,
(4.92)
,
(4.92)
где ![]() - алгебраическая сумма логарифмов
начальных концентраций, каждое из
слагаемых
- алгебраическая сумма логарифмов
начальных концентраций, каждое из
слагаемых
которой умножено на соответствующий коэффициент.
Замена концентраций парциальными давлениями дает в условиях P, T = const:
![]() .
(4.93)
.
(4.93)
Уравнения (4.92) и (4.93) - уравнения изотермы химической реакции или уравнения Вант-Гоффа.
Способность различных веществ взаимодействовать между собой с образованием новых веществ была замечена давно и получила наименование химического сродства. Критерий оценки химического сродства был найден не сразу. Несостоятельным оказалось предположение о равенстве теплового эффекта реакции и сродства.
Голландский физико - химик Вант-Гофф предложил новую теорию химического сродства, которая, не объясняя его природу, дает возможность количественно оценить его: в качестве мерила химического сродства предложено использовать полную максимальную работу реакции, если реакция протекает при V = const:
![]()
или максимальную полезную работу, если реакция протекает в условиях p = const:
![]()
где значения AV и AP могут быть рассчитаны и по уравнениям изотермы химической реакции (4.94).
Для того, чтобы иметь возможность сравнивать сродство различных веществ, было введено понятие нормального (стандартного) сродства.
К уравнению нормального сродства легко подойти, если начальные парциальные давления или концентрации реагентов равны единице.
Тогда:
![]() и
и
![]() .
(4.95)
.
(4.95)
Сравнивая ![]() или
или
![]() различных веществ, получают характеристику
удаленности данной системы от состояния
равновесия.
различных веществ, получают характеристику
удаленности данной системы от состояния
равновесия.
Замечание. Для растворов правильнее пользоваться не молярными концентрациями (Сi) в случае расчета химического сродства, а мольными долями компонентов.
