
- •Введение
- •Глава I. Химическая термодинамика
- •2. Теплоемкость идеального газа.
- •3. Теплоемкость твердых тел.
- •4. Правило Неймана - Коппа.
- •5. Температурная зависимость теплоемкости.
- •6. Квантовая теория теплоемкости
- •Глава III. Применение первого начала к химическим процессам
- •Термохимия – раздел термодинамики
- •2. Связь тепловых эффектов химических реакций при постоянном объеме (qv) и давлении (qp).
- •3. Закон Гесса.
- •4. Следствия из закона Гесса.
- •5. Зависимость теплового эффекта химической реакции от температуры (уравнение Кирхгофа).
- •Глава IV. Второе начало термодинамики.
- •Содержание второго начала термодинамики.
- •2. Обратимые и необратимые процессы.
- •3. Коэффициент полезного действия тепловой машины. Цикл Карно.
- •4. Работа холодильника (теплового насоса).
- •5. Измерение рассеивания энергии. Энтропия.
- •6. Термодинамический взгляд на энтропию.
- •7. Вычисление энтропии.
- •8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
- •9. Энергия Гиббса. Энергия Гельмгольца.
- •10. Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
- •11. Уравнение Гиббса - Гельмгольца.
- •12. Применение второго закона термодинамики к фазовым переходам. Уравнение Клаузиуса - Клапейрона.
- •13. Химическое равновесие. Закон действующих масс и константа равновесия.
- •14. Различные формы констант равновесия и связь между ними.
- •15. Уравнение изотермы химической реакции. Химическое сродство.
- •16. Направление реакций и условие равновесия.
- •17. Зависимость константы равновесия от температуры и давления.
- •18. Равновесие в гетерогенных системах.
- •19. Термическая диссоциация.
- •Глава V. Третий закон термодинамики.
- •Недостаточность I и II законов термодинамики для расчета химического сродства.
- •2. Тепловая теорема Нернста.
- •3. Следствия из тепловой теоремы Нернста.
- •4. Расчет абсолютных значений энтропии.
- •5. Применение таблиц термодинамических функций для расчетов равновесий.
- •Глава VI. Правило фаз.
- •1. Основные понятия и определения.
- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
7. Вычисление энтропии.
В качестве отправной точки необходимо воспользоваться соотношением (4.21).
Тогда для изотермического процесса (Т = const):
![]() ,
,
где dq = dU + pdV, а dU = 0,
поэтому
![]() .
(4.39)
.
(4.39)
Из уравнения состояния идеального газа:
![]() ,
(4.40)
,
(4.40)
если n = 1 моль, следовательно:
![]() .
(4.41)
.
(4.41)
После интегрирования:
![]() .
(4.42)
.
(4.42)
Для случая P = const:
![]() ,
,
где dqP = CPdT, поэтому
![]()
и после интегрирования:
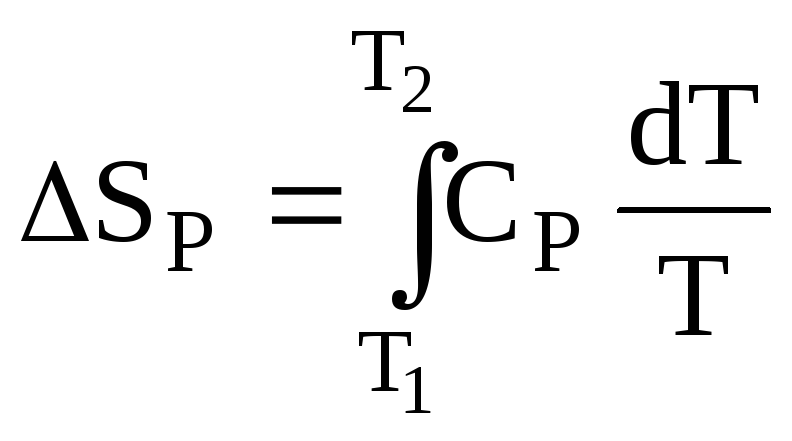 .
(4.43)
.
(4.43)
Если СР = const, то
![]() .
(4.44)
.
(4.44)
По аналогии для случая V = const:
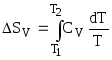 .
(4.45)
.
(4.45)
и если СV = const, то
![]() .
(4.46)
.
(4.46)
Если изотермическое превращение является фазовым - плавление, испарение, сублимация или полиморфный переход, то:
![]() ,
(4.47)
,
(4.47)
где q - энергетический эффект фазового перехода;
Т - температура фазового перехода.
Таким образом, рассмотрены некоторые уравнения, позволяющие вычислять изменение энтропии, если известны изменения параметров системы и ее теплоемкость. Существуют и другие методы определения изменения энтропии, например по измерениям электродвижущих сил гальванических элементов, о чем речь пойдет в главе “Электрохимия”.
8. Направление протекания процессов в изолированных системах и термодинамические условия равновесия.
Из уравнения второго закона термодинамики (4.39) следует, что если dq = 0, то справедливо неравенство:
![]() ,
(4.48)
,
(4.48)
т. е. в изолированной системе самопроизвольно реализуются процессы, сопровождающиеся увеличением энтропии и, как крайний случай, сохранение постоянства энтропии при обратимых процессах.
Самопроизвольный процесс протекает до тех пор, пока система не перейдет в равновесное состояние, для которого энтропия максимальна для заданных условий.
Условие максимума возрастающей функции:
dS = 0 и d2S < 0, (4.49)
которое является справедливым применительно к изолированным системам, т.е. для таких, у которых U и V = const, а также Н и Р.
Тогда (4.48) и (4.49) в более строгой форме записи:
![]() ;
;
![]() и
и![]() .
(4.50)
.
(4.50)
9. Энергия Гиббса. Энергия Гельмгольца.
Энтропия - основная
функция, позволяющая судить о направлении
самопроизвольных процессов в изолированных
системах. Чтобы использовать ее в
практических целях нужно исследовать
как самое систему, так и ее окружение.
Хотя рассчитать изменение энтропии
окружения или окружающей среды довольно
просто
![]() ,
можно предложить метод, автоматически
учитывающий наличие окружающей среды.
,
можно предложить метод, автоматически
учитывающий наличие окружающей среды.
Из первого закона термодинамики следует:
dq = dU +dA.
Из второго закона:
dq
![]() TdS,
TdS,
поэтому
TdS
![]() dU + dA.
(4.51)
dU + dA.
(4.51)
Неревенство (4.51) представляет собой обобщенную форму записи первого и второго начал термодинамики.
Из (4.51) следует, что:
dA
![]() TdS - dU.
(4.52)
TdS - dU.
(4.52)
При постоянных Т и V (4.52) интегрируется непосредственно:
AV
![]() T(S2
- S1)
- (U2
- U1)
T(S2
- S1)
- (U2
- U1)
или
AV
![]() TS2
- TS1
- U2
+ U1,
TS2
- TS1
- U2
+ U1,
откуда
AV
![]() -[( U2
-
TS2)
- (U1
- TS1)],
(4.53)
-[( U2
-
TS2)
- (U1
- TS1)],
(4.53)
где U - TS = F, поэтому:
AV
![]() -( F2 -
F1)
или
-( F2 -
F1)
или
![]() .
(4.54)
.
(4.54)
F - новая функция состояния, называемая энергией Гельмгольца (свободная энергия при постоянном объеме системы или изохорно-изотермический термодинамический потенциал).
Соотношение (4.54) читается: “... работа неизолированной системы в условиях V, T = const не более убыли энергии Гельмгольца”.
Величина АР
= AV
- p![]() есть величина максимальной полезной
работы, где АV
- максимальная полная работа.
есть величина максимальной полезной
работы, где АV
- максимальная полная работа.
По аналогии АР может быть определена в виде разности двух значений некоторой функции G - энергии Гиббса:
AР
![]() -( G2 -
G1)
или
-( G2 -
G1)
или
![]() .
(4.55)
.
(4.55)
Так же как энтальпия отличается от внутренней энергии на величину pV, так и G отличается от F на величину pV:
G = F + pV = U - TS + pV = H - TS. (4.56)
Итак, окончательно:
F = U - TS и G = H - TS, (4.57)
где F и G - новые функции состояния.
