
- •Комплексонометрия Медико-биологическая роль комплексных соединений.
- •Учебно-целевые вопросы к занятиям
- •Металлохромные индикаторы
- •Условия титрования в методе комплексонометрии
- •Лабораторная работа
- •Техника определения жесткости воды.
- •Контрольные вопросы
- •Рекомендуемая литература
- •Правила техники безопасности при работе в химической лаборатории
- •Введение в титриметрический анализ.
- •Цель занятия
- •Посуда, используемая в объемном анализе
- •Возможные ошибки в объемном анализе
- •Классификация методов титриметрического анализа
- •Способы титрования в объемном анализе
- •Расчеты в титриметрическом анализе
- •Способы выражения концентрации растворов.
- •Формулы для перерасчета концентраций.
Учебно-целевые вопросы к занятиям
Комплексные соединения, номенклатура, изомерия, диссоциация.
Основные положения координационной теории Вернера, Чугаева.
Комплексообразователь и его координационное число.
Лиганды.
Внутрикомплексные соединения.
Комплексонометрия: рабочие растворы и индикаторы.
Определение точки эквивалентности.
Лабораторная работа. «Определение жесткости воды и двухзарядных ионов в растворах»
В основе метода комплексонометрии лежит образование внутрикомплексных соединений ионов металлов с комплексонами (рабочий раствор).
Титр комплексона (раствор трилона Б) устанавливается по исходному веществу. В качестве исходных веществ в комплексонометрии используют химически чистые хлорид магния или цинка, карбонат кальция.
Точка эквивалентности в комплексонометрии устанавливается с помощью металлохромных индикаторов.
Комплексоны – это группа органических соединений, являющихся производными аминополикарбоновых кислот, из которых простейшей можно считать аминодиуксусную кислоту (комплексон I):

Наиболее распространенными комплексонами являются следующие вещества:
1.нитрилотриуксусная кислота или комплексон:
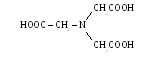
2.этилендиаминтетрауксусная кислота или комплексон II[H4T]:

3.двунатриевая соль этилендиаминтетрауксусной кислоты или комплексон III, которую называют трилоном Б [Na2H2T]:

На практике часто используют хорошо растворимую в воде натриевую соль этилендиаминтетрауксусной кислоты или трилон Б.
Комплексоны отличаются полидентатностью, т.е. способностью образовывать сразу несколько координационных связей, с ионами металлов комплексообразователей –ковалентные связи с карбоксильными группами (-СООН) и донорно-акцепторные связи с азотом аминогруппы (:N≡). Соединения подобного типа называются внутрикомплексными (хелатными или клешневидными) соединениями.
Комплексон III, трилон Б диссоциирует в водном растворе с образованием ионов Н2Т2-:
Na2H2T→ 2Na++H2T2-,
которые связывают катионы металлов, имеющих разные степени окисления, в бесцветные комплексные соединения (комплексонаты металлов):
Me2+ + H2T2- ↔ MeT2- + 2H+
Me3+ + H2T2- ↔ MeT- + 2H+
Me4+ + H2T2- ↔MeT + 2H+
Cтроение комплексонатов металлов можно схематически выразить формулами:



Как видно из уравнений реакций, взаимодействие комплексона IIIс катионами металлов имеет ряд особенностей:
Реакции между комплексоном IIIи катионами металлов протекают с образованием комплексов строго определенного состава, в которых отношение метала к лиганду равно 1:1 независимо от степени окисления металла.
Увеличение степени окисления металла приводит к увеличению числа координационных связей.
Прочность образуемых комплексов обусловлена наличием в них одновременно как ковалентных, так и донорно-акцепторных связей. Наибольшей прочностью обладают комплексонаты катионов Ме3+и Ме4+. КомплексонIII(трилон Б) находит применение для количественного определения многих катионов металлов, например:Ca2+,Cu2+,Ba2+,Zn2+,Fe3+,Al3+,Mn2+, редкоземельных элементов и анионов, напримерSO42-,CO32-,PO43-, и др.(косвенным методом).
Кроме того, комплексон IIIиспользуют для смягчения воды, в фармацевтическом и химическом производствах.
В медицине комплексоны применяют для лечения «лучевой болезни», при свинцовых и ртутных отравлениях, для растворения почечных камней, в санитарно-гигиеническом анализе питьевой воды (определяют жесткость воды).
