
- •Глава 1 Элементы кинематики
- •§ 1. Модели в механика. Система отсчета. Траектория, длина пути, вектор перемещения
- •§ 2. Скорость
- •§ 3. Ускорение и его составляющие
- •2) Прямолинейное равнопеременное движение. При таком виде движения
- •4)Прискорость по модулю не изменяется, а изменяется по направлению. Из формулыследует, что радиус кривизны должен быть постоянным. Следовательно, движение по окружности является равномерным;
- •§ 4. Угловая скорость и угловое ускорение
- •Глава 2
- •§ 5. Первый закон Ньютона. Масса. Сила
- •§ 7. Третий закон Ньютона
- •§ 8. Силы трения
- •§ 9. Зеком сохранения импульса. Центр масс
- •§ 10. Уравнение движения тала переменной массы
- •Глава 3 Работа и энергия
- •§ 11. Энергия, работа, мощность
- •§ 12. Кинетическая и потенциальная энергии
- •§ 13. Закон сохранения энергии
- •§ 14. Графическое представление энергии
- •§ 15. Удар абсолютно упругих и неупругих тал
- •Глава 4Механика твердого тела
- •§ 16. Момент инерции
- •§ 17. Кинетическая энергия вращения
- •§ 18. Момент силы. Уравнение динамики вращательного движения твердого тела
- •§ 19. Момент импульса и закон его сохранения
- •§ 20. Свободные оси. Гироскоп
- •§ 21. Деформации твердого тела
- •Глава 5 Тяготение. Элементы теории поля
- •§ 22. Законы Кеплера. Закон всемирного тяготения
- •§ 23. Сила тяжести и вес. Невесомость
- •§ 24. Поле тяготения и его напряженность
- •§ 25. Работа в поле тяготения. Потенциал поля тяготения
- •§ 26. Космические скорости
- •§ 27. Неинерционные системы отсчета. Силы инерции
- •1. Силы инерции при ускоренном поступательном движении системы отсчет». Пусть на тележке к штативу на нити подвешен шарик массой т (рис. 40). Пока тележка покоится или движется
- •2. Силы вверим, действующие на тело, покоящееся во вращающейся системе отсчета. Пусть диск равномерно вращается с угловой скоростьювокруг вертикальной оси, проходящей через
- •Глава 6 Элементы механики жидкостей
- •§ 28. Давление в жидкости и газа
- •§ 29. Уравнение неразрывности
- •§ 30. Уравнение Бернулли и следствия из него
- •§ 31. Вязкость (внутреннее трение). Ламинарный и турбулентный режимы течения жидкостей
- •§ 32. Методы определения вязкости
- •§ 33. Движение тел в жидкостях и газах
- •5.3. Сопло фонтана, дающего вертикальную струю высотой имеет форму усеченного
- •5.5. В широком сосуде, наполненном глицерином (плотность падает с устано-
- •Глава 7
- •§ 34. Преобразования Галилея. Механический принцип относительности
- •§ 35. Постулаты специальной (частной) теории относительности
- •§ 38. Преобразования Лоренца
- •§ 37. Следствия из преобразований Лоренца
- •1. Одновременность событий в разных системах отсчета. Пусть в системе к в точках с координатамив моменты временипроисходят два события. В системе
- •§ 38. Интервал между событиями
- •§ 39. Основной закон релятивистской динамики материальной точки
- •§ 40. Закон взаимосвязи массы и энергии
- •Глава 8
- •§ 41. Статистический и термодинамический методы. Опытные законы идеального газа
- •2) Давление данной массы газа при постоянном объеме изменяется линейно с температурой:
- •§ 42. Уравнение Клапейрона — Менделеева
- •§ 43. Основное уравнение молекулярно-кинетической теории идеальных газов
- •§ 44. Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
- •2) Средняя3) средняя квадратичная
- •§ 45. Барометрическая формула. Распределение Больцмана
- •§ 46. Среднее число столкновений и средняя длина свободного пробега молекул
- •§ 47. Опытное обоснование молокулярно-кинггичоской теории
- •§ 48. Явления переноса в термодинамически неравновесных системах
- •§ 48. Вакуум и методы его получения. Свойства ультраразреженных газов
- •Глава 9 Основы термодинамики
- •§ 51. Первое начало термодинамики
- •§ 52. Работа газа при изменении его объема
- •§ 53. Теплоемкость
- •§ 54. Применение первого начала термодинамики к изопроцессам
- •§ 55. Адиабатический процесс. Политропный процесс
- •§ 56. Круговой процес (цикл). Обратимый и необратимый процессы
- •§ 57. Энтропия, её статистическое толкование и связь с термодинамической вероятностью
- •§ 58. Второе начало термодинамики
- •2)ПоКлаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
- •§ 59. Тепловые двигатели и холодильные машины. Цикл Карно и его к. П. Д. Для идеального газа
- •Глава 10 Реальные газы, жидкости и твердые тела
- •§ 60. Силы и потенциальная энергия межмолекулярного взаимодействия
- •§ 61. Уравнение Ван-дер-Ваальса
- •§ 62. Изотермы Ван-дер-Ваальса и их анализ
- •§ 63. Внутренняя энергия реального газа
- •§ 64. Эффект Джоуля — Томсона
- •§ 65. Сжижение газов
- •§ 66. Свойства жидкостей. Поверхностное натяжение
- •§ 67. Смачивание
- •§ 68. Давление под искривленной поверхностью жидкости
- •§69. Капиллярные явления
- •§ 70. Твердыt тала. Моно- и поликристаллы
- •§ 71. Типы кристаллических твердых тел
- •§ 72. Дефекты в кристаллах
- •§ 73. Теплоемкость твердых тел
- •1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
- •§ 74. Испарение, сублимация, плавление и кристаллизация. Аморфные тела
- •§75. Фазовые переходы I и п рода
- •§ 76. Диаграмма состояния. Тройная точка
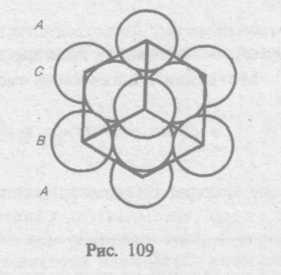
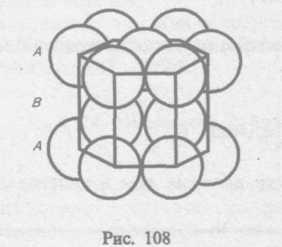
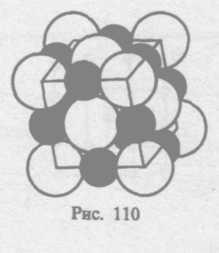
§ 72. Дефекты в кристаллах
Рассмотренные
в § 71 идеальные кристаллические структуры
существуют лишь в очень малых
объемах реальных кристаллов, в которых
всегда имеются отклонения от упорядоченного
расположения частиц в узлах решетки,
называемые дефектами
кристаллической
решетка. Дефекты делятся на
макроскошпические, возникающие в
процессе образования
и роста кристаллов (например, трещины,
поры, инородные макроскопические
включения), и макроскопические,
обусловленные микроскопическими
отклонениями
от периодичности.
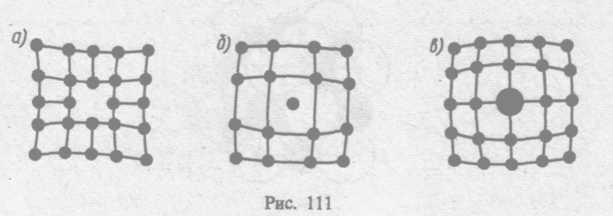
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов: 1) вакансия — отсутствие атома в узле кристаллической решетки (рис. 111, а); 2) междоуэельный атом — атом; внедрившийся в междоузельное пространство (рис. 111, 6); 3) примесный атом — атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения, рис. 111, в), либо внедрившийся в междоузельное пространство (примесь введения, рис. 111, б; только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, — в этом состоит их характерная особенность.
Линейные дефекты нарушают дальний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида — дислокациями. Дислокации — линейные дефекты, нарушающие правильное чередование атомных плоскостей.

 Дислокации
бывают краевые и винтовые. Если одна
из атомных плоскостей обрывается
внутри кристалла, то край этой плоскости
образует краевую дислокацию (рис.
112, а).
В
случае винтовой дислокации (рис. 112, б)
ни одна из атомных плоскостей внутри
кристалла не обрывается, а сами плоскости
лишь приблизительно параллельны и
смыкаются друг с другом так, что
фактически кристалл состоит из одной
атомной плоскости, изогнутой по винтовой
поверхности.
Дислокации
бывают краевые и винтовые. Если одна
из атомных плоскостей обрывается
внутри кристалла, то край этой плоскости
образует краевую дислокацию (рис.
112, а).
В
случае винтовой дислокации (рис. 112, б)
ни одна из атомных плоскостей внутри
кристалла не обрывается, а сами плоскости
лишь приблизительно параллельны и
смыкаются друг с другом так, что
фактически кристалл состоит из одной
атомной плоскости, изогнутой по винтовой
поверхности.
Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов составляет 102—103 см -2, для деформированных кристаллов— 1010 —1012 см -2. Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций. Дислокации и их движение можно наблюдать с помощью электронного микроскопа, а также методом избирательного травления — в местах выхода дислокации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации.
Наличие дефектов в кристаллической структуре влияет на свойства кристаллов, анализ которых проведем ниже.
§ 73. Теплоемкость твердых тел
В
качестве модели твердого тела рассмотрим
правильно построенную кристаллическую
решетку, в узлах которой частицы (атомы,
ионы, молекулы), принимаемые за
материальные
точки, колеблются около своих положений
равновесия — узлов решетки
— в трех взаимно перпендикулярных
направлениях. Таким образом, каждой
составляющей
кристаллическую решетку частице
приписывается три колебательных степени
свободы,
каждая из которых, согласно закону
равнораспределения энергии по степеням
свободы
(см. § 50), обладает энергией![]()
Внутренняя энергия моля твердого тела
![]()
где![]() —
постоянная Авогадро;N^k=R
(R
—
молярная газовая постоянная). Молярная
теплоемкость твердого тела
—
постоянная Авогадро;N^k=R
(R
—
молярная газовая постоянная). Молярная
теплоемкость твердого тела
![]() Дж/(мольК), (73.1)
Дж/(мольК), (73.1)
т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом
состоянии одинакова (равна 3R) и не зависит от температуры. Этот закон был эмпирически получен французскими учеными П. Дюлонгом (1785—1838) и Л. Пти (1791—1820) и носит название закона Дюлонга и Птм.
Если твердое тело является химическим соединением (например, NaCl), то число частиц в моле не равно постоянной Авогадро, а равно nNA, где n— число атомов в молекуле (для NaCl число частиц в моле равно 2NA, так, в одном моле NaCl содержится NA атомов Na н NA атомов Cl). Таким образом, молярная теплоемкость твердых химических соединений
![]()
т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.
Как показывают опытные данные (табл. 4), для многих веществ закон Дю- Таблица 4
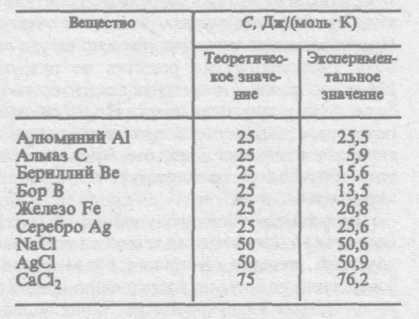
лонга и Пти выполняется с довольно хорошим приближением, хотя некоторые вещества (С, Be, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, так же как и в случае газов (см. § S3), опыты по измерению теплоемкости твердых тел при низких температурах показали, что она зависит от температуры (рис. 113). Вблизи нуля кельвин теплоемкость тел пропорциональна Т3, и только при достаточно высоких температурах, характерных для каждого вещества, выполняется условие (73.1). Алмаз, например, имеет теплоемкость, равную 3R при
