
- •Глава 1 Элементы кинематики
- •§ 1. Модели в механика. Система отсчета. Траектория, длина пути, вектор перемещения
- •§ 2. Скорость
- •§ 3. Ускорение и его составляющие
- •2) Прямолинейное равнопеременное движение. При таком виде движения
- •4)Прискорость по модулю не изменяется, а изменяется по направлению. Из формулыследует, что радиус кривизны должен быть постоянным. Следовательно, движение по окружности является равномерным;
- •§ 4. Угловая скорость и угловое ускорение
- •Глава 2
- •§ 5. Первый закон Ньютона. Масса. Сила
- •§ 7. Третий закон Ньютона
- •§ 8. Силы трения
- •§ 9. Зеком сохранения импульса. Центр масс
- •§ 10. Уравнение движения тала переменной массы
- •Глава 3 Работа и энергия
- •§ 11. Энергия, работа, мощность
- •§ 12. Кинетическая и потенциальная энергии
- •§ 13. Закон сохранения энергии
- •§ 14. Графическое представление энергии
- •§ 15. Удар абсолютно упругих и неупругих тал
- •Глава 4Механика твердого тела
- •§ 16. Момент инерции
- •§ 17. Кинетическая энергия вращения
- •§ 18. Момент силы. Уравнение динамики вращательного движения твердого тела
- •§ 19. Момент импульса и закон его сохранения
- •§ 20. Свободные оси. Гироскоп
- •§ 21. Деформации твердого тела
- •Глава 5 Тяготение. Элементы теории поля
- •§ 22. Законы Кеплера. Закон всемирного тяготения
- •§ 23. Сила тяжести и вес. Невесомость
- •§ 24. Поле тяготения и его напряженность
- •§ 25. Работа в поле тяготения. Потенциал поля тяготения
- •§ 26. Космические скорости
- •§ 27. Неинерционные системы отсчета. Силы инерции
- •1. Силы инерции при ускоренном поступательном движении системы отсчет». Пусть на тележке к штативу на нити подвешен шарик массой т (рис. 40). Пока тележка покоится или движется
- •2. Силы вверим, действующие на тело, покоящееся во вращающейся системе отсчета. Пусть диск равномерно вращается с угловой скоростьювокруг вертикальной оси, проходящей через
- •Глава 6 Элементы механики жидкостей
- •§ 28. Давление в жидкости и газа
- •§ 29. Уравнение неразрывности
- •§ 30. Уравнение Бернулли и следствия из него
- •§ 31. Вязкость (внутреннее трение). Ламинарный и турбулентный режимы течения жидкостей
- •§ 32. Методы определения вязкости
- •§ 33. Движение тел в жидкостях и газах
- •5.3. Сопло фонтана, дающего вертикальную струю высотой имеет форму усеченного
- •5.5. В широком сосуде, наполненном глицерином (плотность падает с устано-
- •Глава 7
- •§ 34. Преобразования Галилея. Механический принцип относительности
- •§ 35. Постулаты специальной (частной) теории относительности
- •§ 38. Преобразования Лоренца
- •§ 37. Следствия из преобразований Лоренца
- •1. Одновременность событий в разных системах отсчета. Пусть в системе к в точках с координатамив моменты временипроисходят два события. В системе
- •§ 38. Интервал между событиями
- •§ 39. Основной закон релятивистской динамики материальной точки
- •§ 40. Закон взаимосвязи массы и энергии
- •Глава 8
- •§ 41. Статистический и термодинамический методы. Опытные законы идеального газа
- •2) Давление данной массы газа при постоянном объеме изменяется линейно с температурой:
- •§ 42. Уравнение Клапейрона — Менделеева
- •§ 43. Основное уравнение молекулярно-кинетической теории идеальных газов
- •§ 44. Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
- •2) Средняя3) средняя квадратичная
- •§ 45. Барометрическая формула. Распределение Больцмана
- •§ 46. Среднее число столкновений и средняя длина свободного пробега молекул
- •§ 47. Опытное обоснование молокулярно-кинггичоской теории
- •§ 48. Явления переноса в термодинамически неравновесных системах
- •§ 48. Вакуум и методы его получения. Свойства ультраразреженных газов
- •Глава 9 Основы термодинамики
- •§ 51. Первое начало термодинамики
- •§ 52. Работа газа при изменении его объема
- •§ 53. Теплоемкость
- •§ 54. Применение первого начала термодинамики к изопроцессам
- •§ 55. Адиабатический процесс. Политропный процесс
- •§ 56. Круговой процес (цикл). Обратимый и необратимый процессы
- •§ 57. Энтропия, её статистическое толкование и связь с термодинамической вероятностью
- •§ 58. Второе начало термодинамики
- •2)ПоКлаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
- •§ 59. Тепловые двигатели и холодильные машины. Цикл Карно и его к. П. Д. Для идеального газа
- •Глава 10 Реальные газы, жидкости и твердые тела
- •§ 60. Силы и потенциальная энергия межмолекулярного взаимодействия
- •§ 61. Уравнение Ван-дер-Ваальса
- •§ 62. Изотермы Ван-дер-Ваальса и их анализ
- •§ 63. Внутренняя энергия реального газа
- •§ 64. Эффект Джоуля — Томсона
- •§ 65. Сжижение газов
- •§ 66. Свойства жидкостей. Поверхностное натяжение
- •§ 67. Смачивание
- •§ 68. Давление под искривленной поверхностью жидкости
- •§69. Капиллярные явления
- •§ 70. Твердыt тала. Моно- и поликристаллы
- •§ 71. Типы кристаллических твердых тел
- •§ 72. Дефекты в кристаллах
- •§ 73. Теплоемкость твердых тел
- •1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
- •§ 74. Испарение, сублимация, плавление и кристаллизация. Аморфные тела
- •§75. Фазовые переходы I и п рода
- •§ 76. Диаграмма состояния. Тройная точка
2) Давление данной массы газа при постоянном объеме изменяется линейно с температурой:
р = Ро (1+аt) при V = const, т = const. (41.3)
В этих уравнениях t — температура по шкале Цельсия, ро и Vo — давление и объем при 0°С, коэффициент а= 1/273,15 К-1.
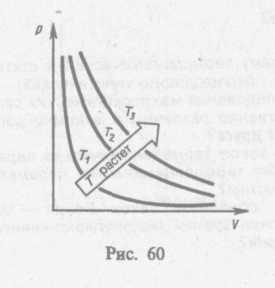
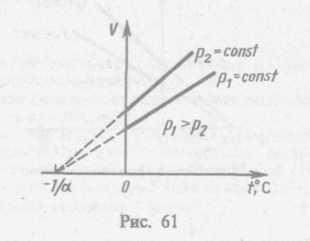
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t (рис. 61) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме, называется нзохорным. На диаграмме в координатах р, t (рис. 62) он изображается прямой, называемой нзохорон.
Из (41.2) и (41.3) следует, что изобары и изохоры пересекают ось температур в точке t= -1/a=— 273,15 0С, определяемой из условия 1+аt=0. Если перенести начало отсчета в эту точку, то происходит переход к шкале Кельвина (рис. 62), откуда
Т = t + 1/а.
Вводя в формулы (41.2) и (41.3) термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:
V= Vо (1 + at) = Vo [1 + а (T- 1/а)] = Vo aT,
♦ Р.
Бойль (1627—1691) —английский ученый;
Э. Мариотт (1620—1684) — французский физик.
Р.
Бойль (1627—1691) —английский ученый;
Э. Мариотт (1620—1684) — французский физик.
••Ж. Гей-Люссак (1778—1850) — французский ученый.

![]() (41.4)
(41.4)
![]() (41.5)
(41.5)
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
Закон
Авогадро *: моли любых газов при одинаковых
температуре и давлении занимают![]() одинаковые
объемы. При нормальных условиях
этот объем равен
одинаковые
объемы. При нормальных условиях
этот объем равен
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:
![]()
Закон
Дальтона**:
давление смеси идеальных газов равно
сумме парциальных давлений![]() входящих
в нее газов:
входящих
в нее газов:
![]()
Парциальное давление — давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
§ 42. Уравнение Клапейрона — Менделеева
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением
![]()
где каждая из переменных является функцией двух других.
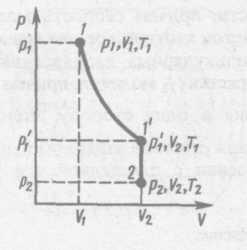
Французский физик и инженер Б. Клапейрон (1799—1864) вывел уравнение состояния идеального газа, объединив законы Бойля — Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1 имеет давление р1 ,и находится при температуре Т\. Эта же масса газа в другом произвольном состоянии характеризуется
* А.
Авогадро (1776—1856) — итальянский физик
и химик. **Дж. Дальтон (1766—1844) — английский
химик и физик.
А.
Авогадро (1776—1856) — итальянский физик
и химик. **Дж. Дальтон (1766—1844) — английский
химик и физик.


параметрами![]() (рис.
63). Переход из состояния 1 в состояние
2
осуществляется
(рис.
63). Переход из состояния 1 в состояние
2
осуществляется
в виде двух процессов: 1) изотермического (изотерма 1 — 1,), 2) изохорного (изохора 1,-2).
В соответствии с законами Бойля — Мариотта (41.1) и Гей-Люссака (41.5) запишем:
![]() (42.1)
(42.1)
![]() (42.2)
Исключив
из уравнений (42.1) и (42.2)
(42.2)
Исключив
из уравнений (42.1) и (42.2)![]() получим
получим
![]()
Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина pV/T остается постоянной, т. е.
pV/T = В = const. (42.3)
Выражение (42.3) является уравнением Клапейрона, в котором В — газовая постоянная, различная для разных газов.
Русский ученый Д. И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (42.3) к одному молю, использовав молярный объем Vm. Согласно закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной. Уравнению
pVm = RT (42.4)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клапейрона — Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (42.4), полагая, что моль газа находится при нормальных условиях (ро= 1,013 105 Па,
Т0=273,15 К, Vm=22,41.10-3 м3/моль): R=8,31 Дж/ДмольК).
От уравнения (42.4) для моля газа можно перейти к уравнению Клапейрона — Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем Vm, то при тех же


условиях масса т газа займет объем V= (m/M) Vm, где М — молярная масса (масса
одного моля вещества). Единица молярной массы — килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массы т газа
![]() (42.5)
(42.5)
где![]() —
количество вещества.
—
количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
![]()
Исходя из этого уравнение состояния (42.4) запишем в виде
![]()
где![]() —
концентрация молекул (число молекул в
единице объема). Таким
—
концентрация молекул (число молекул в
единице объема). Таким
образом, из уравнения
![]() (42.6)
(42.6)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1 м3 газа при нормальных условиях, называется числом Лошмидта*:
![]()
